题目内容
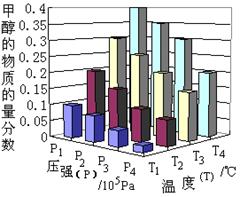
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色)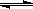 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
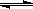 N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色
(填“变深”、“变浅”或“不变”)
(1)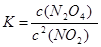 (2分)(2)0.1(2分)(3)t3 (1分)
(2分)(2)0.1(2分)(3)t3 (1分)
(4)> (1分)(5)正反应应方向(1分)(6)变深 (1分)
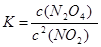 (2分)(2)0.1(2分)(3)t3 (1分)
(2分)(2)0.1(2分)(3)t3 (1分)(4)> (1分)(5)正反应应方向(1分)(6)变深 (1分)
(1)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式为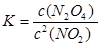 。
。
(2)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是1mol÷1L÷10s=0.1mol/(L·s)。
(3)根据图像可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态。
(4)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率。
(5)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动,
(6)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。
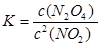 。
。(2)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是1mol÷1L÷10s=0.1mol/(L·s)。
(3)根据图像可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态。
(4)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率。
(5)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动,
(6)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

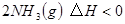 ,工业上选择的适宜条件为:
,工业上选择的适宜条件为: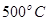 、铁作催化剂、
、铁作催化剂、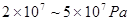 。下列说法正确的是
。下列说法正确的是 CO(气)+H2(气); CO(气)+H2O(气)
CO(气)+H2(气); CO(气)+H2O(气)  2YX3(g) △H
2YX3(g) △H 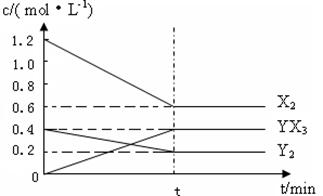
 2HI(g),能说明此反应已达到平衡的是
2HI(g),能说明此反应已达到平衡的是 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。 C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( )
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( ) CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。
CH3OH(g)+H2O(g) +49.0 kJ。反应在2分钟时达到了平衡。