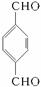
题目内容
按下列要求填空(共12分)
①向碳酸氢钙溶液中加入少量氢氧化钠溶液的离子方程式:________________________。
氯化铝溶液与NaHCO3溶液混合的离子方程式:_____________________________________。
②在KClO3 + 6HCl = KCl + 3Cl2 ↑ + 3H2O的反应中,被氧化的氯原子与被还原的氯原子的物质的量之比是_______________。
③强酸性的未知无色溶液中可能含有大量的Cl-、S2-、NO3-、CO32-、NH4+、Cu2+、Fe3+、Ag+等,现已检出有Ag+,你认为其中 __ __离子还需要鉴定是否存在,请写出检验该离子的离子方程式_____________________。
④某化合物的相对分子质量为m,在t℃时AmL该化合物的饱和溶液为Bg,将其蒸干后得到固体Cg。该化合物在t℃时的溶解度为 __g,该饱和溶液中溶质的物质的量浓度为 mol/L。
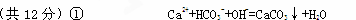
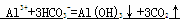


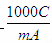
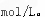
【解析】略

(共13分)〔一〕实验室用氢氧化钠配制1.00mol/L的氢氧化钠溶液0.2L,回答下列问题
(1)下列有关使用托盘天平的叙述,正确的是 。
A.称量前先调节天平的零点。
B.称量时左盘放被称量物,右盘放砝码。
C.氢氧化钠必须放在玻璃器皿里称量。
D.称量时,应先加质量小后加质量大的砝码至天平平衡。
E.称量完毕,应把天平放回砝码盒中。
(2)某同学用托盘天平称取一盛有氢氧化钠药品的烧杯,若左盘上放有30g砝码,游码位置如下图所示,天平的指针指在标尺的中间。则烧杯和粉剂的总质量为_________克。
〔二〕用98%的浓H2SO4(ρ=1.84g/cm3)配制成0.5mol/L的稀H2SO4 500ml的操作步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容、摇匀 ,请按要求填空:
(1)如果实验室有15mL、20mL、50mL量筒,应选用 mL量筒最好。
(2)第⑤步实验的操作是(文字叙述)_______________________________________________
(3)某学生的下列操作中使浓度偏低的原因是: 。
① 用量筒量取浓硫酸时,俯视读数。
② 量筒中浓硫酸全部转入烧杯中稀释后,再转移到100ml容量瓶中,烧杯未洗涤。
③ 用玻璃棒引流,将溶液转移到容量瓶中有溶液流到了容量瓶外面。
④ 浓硫酸在小烧杯中稀释后,没有冷却就马上转移入容量瓶。
⑤ 用胶头滴管加蒸馏水时,加入过快而使液面超过了刻度线,立即用滴管吸去多余的水,使溶液凹石刚好与刻度线相切。
⑥ 滴加入蒸馏水,使溶液凹面刚好与刻度线相切,盖上瓶塞反复摇匀后,静置,发现液石比刻度线低,再加水至刻度线。