题目内容
将下列物质:①CH4、②Ar、③NH3、④MgO、⑤SiO2、⑥NaOH、⑦NH4Cl按要求填空(填写序号,错一个扣一分):(1)微粒间只存在共价键的是 ,只存在离子键的是 ,既存在离子键,又存在共价键的是 .
(2)属于离子化合物的是 ,其中只有离子键的化合物的电子式为 .
(3)属于共价化合物的是 .
【答案】分析:(1)根据离子键、共价键的定义判断;
(2)根据化合物中含有的化学键类型判断;
(3)根据化合物中含有的化学键类型判断;
解答:解:离子键:原子通过电子的得失形成阴阳离子,阴阳离子间通过静电作用所形成的化学键.活泼金属和活泼非金属一般形成离子键.
共价键:原子间通过共用电子对所形成的化学键.非金属元素间一般形成共价键.
(1)故答案为:CH4,NH3,SiO2; MgO; NaOH,NH4Cl.
(2)离子化合物:含有离子键的化合物.故答案为:MgO,NaOH,NH4Cl; .
.
(3)共价化合物:只含有共价键的化合物,故答案为:CH4,NH3,SiO2.
点评:离子化合物、共价化合物的判断方法:
1、根据化合元素的性质判断;活泼金属和活泼非金属一般形成离子键.非金属元素间一般形成共价键.
2、根据组成化合物的粒子类型判断.
3、根据化合物的基本类型判断;大部分盐和常见的强碱和中强碱是离子化合物,弱碱是共价化合物.
4、根据化合物的导电性判断;在熔融状态下能导电的化合物是离子化合物.
5、根据化合物的熔沸点判断,熔沸点较高或很高的可能是离子化合物.
(2)根据化合物中含有的化学键类型判断;
(3)根据化合物中含有的化学键类型判断;
解答:解:离子键:原子通过电子的得失形成阴阳离子,阴阳离子间通过静电作用所形成的化学键.活泼金属和活泼非金属一般形成离子键.
共价键:原子间通过共用电子对所形成的化学键.非金属元素间一般形成共价键.
(1)故答案为:CH4,NH3,SiO2; MgO; NaOH,NH4Cl.
(2)离子化合物:含有离子键的化合物.故答案为:MgO,NaOH,NH4Cl;
 .
.(3)共价化合物:只含有共价键的化合物,故答案为:CH4,NH3,SiO2.
点评:离子化合物、共价化合物的判断方法:
1、根据化合元素的性质判断;活泼金属和活泼非金属一般形成离子键.非金属元素间一般形成共价键.
2、根据组成化合物的粒子类型判断.
3、根据化合物的基本类型判断;大部分盐和常见的强碱和中强碱是离子化合物,弱碱是共价化合物.
4、根据化合物的导电性判断;在熔融状态下能导电的化合物是离子化合物.
5、根据化合物的熔沸点判断,熔沸点较高或很高的可能是离子化合物.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
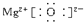
 ),
),