题目内容
【题目】对于在密闭容器中的可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A. 达到化学平衡状态时,4v正(O2)=5v逆(NO)
B. 当气体的平均相对分子质量不变时,反应达到平衡
C. 达到化学平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 其他条件不变,增大体系压强,化学平衡常数减小
【答案】AB
【解析】A项,反应达到平衡状态时,正逆反应速率相等,用不同物质表示的反应速率之比等化学计量数之比,则4v正(O2)=5v逆(NO),说明消耗氧气的速率等于生成氧气的速率,故A正确;B项,该反应正向是一个气体分子数增大的反应,只要不平衡,气体的平均相对分子质量就会变化,当气体的平均相对分子质量不变时,说明反应已达到平衡,故B正确;C项,达到化学平衡状态时,若增加容器体积,反应物和生成物的浓度都减小,,则正逆反应速率都减小,故C错误;D项,影响化学平衡常数的外因只有温度,所以其他条件不变,增大体系压强,化学平衡常数不变,故D错误。

练习册系列答案
相关题目
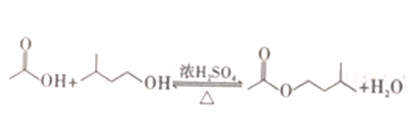
【题目】工业上用过量的乙酸和异成醇制备乙酸异戊酯,原理(如图所示) 和有关数据如下:
物质 | 相对分子质量 | 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解度 |
异戊醇 | 88 | 0.8123 | -117 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 17 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | -78 | 142 | 难溶 |
下列说法正确的是
A. 常温下,可用过滤的方法分离乙酸异戊酯和水溶液
B. 反应中,加入过量的乙酸的主要目的是加快该反应的反应速率
C. 为了除去产物中混有的乙酸,可以向混合物中加入足量饱和Na2CO3溶液,充分振荡后静置、分液
D. 为了除去产物中混有的异戊醇,应选择如图所示装置中的c装置