题目内容
【题目】体积为1L的某溶液中可能含有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 取该溶液100mL,加入过量NaOH溶液,加热,得到
取该溶液100mL,加入过量NaOH溶液,加热,得到![]() 气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到
气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到![]() 固体;向上述滤液中加入足量
固体;向上述滤液中加入足量![]() 溶液,得到
溶液,得到![]() 不溶于盐酸的沉淀.下列叙述正确的是()
不溶于盐酸的沉淀.下列叙述正确的是()
A.溶液中的主要离子仅为![]() 、
、![]() 、
、![]()
B.![]() 一定存在,且
一定存在,且![]()
C.向原溶液中加入硫酸,可能有气体生成
D.![]() 、
、![]() 一定不存在,
一定不存在,![]() 可能存在
可能存在
【答案】C
【解析】
加入NaOH溶液共热有气体和白色沉淀,气体为氨气,白色沉淀转化为灰绿色,最后转化为为氢氧化铁,则溶液中一定含有![]() 、
、![]() ,根据离子共存可知不含
,根据离子共存可知不含![]() ,加
,加![]() 溶液生成不溶于盐酸的沉淀,知溶液中含
溶液生成不溶于盐酸的沉淀,知溶液中含![]() ,
,![]() ,知
,知![]() ,n(Fe2O3)=
,n(Fe2O3)=![]() =0.01mol,根据元素守恒,知
=0.01mol,根据元素守恒,知![]() ,n(Ba
,n(Ba
SO4)= ![]() =0.02mol,知
=0.02mol,知![]() , 溶液中
, 溶液中![]() 、
、![]() 所带正电荷为
所带正电荷为![]() ,
,![]() 所带负电荷为
所带负电荷为![]() ,据电荷守恒,知溶液中必然大量存在另一种阴离子,所以
,据电荷守恒,知溶液中必然大量存在另一种阴离子,所以![]() 、硝酸根离子至少存在一种,故原溶液中一定含
、硝酸根离子至少存在一种,故原溶液中一定含![]() 、
、![]() 、
、![]() 和
和![]() 、硝酸根离子中的至少一种,钾离子、铝离子无法判断;
、硝酸根离子中的至少一种,钾离子、铝离子无法判断;
A.原溶液中一定含![]() 、
、![]() 、
、![]() 和
和![]() 、硝酸根离子中的至少一种,故A错误;
、硝酸根离子中的至少一种,故A错误;
B.液中![]() 、
、![]() 所带正电荷为
所带正电荷为![]() ,
,![]() 所带负电荷为
所带负电荷为![]() ,据电荷守恒,知溶液中必然大量存在另一种阴离子,
,据电荷守恒,知溶液中必然大量存在另一种阴离子,![]() 、硝酸根离子中的至少一种,故B错误;
、硝酸根离子中的至少一种,故B错误;
C.向原溶液中加入硫酸,可能存在硝酸根离子,硝酸能将亚铁离子氧化,产生一氧化氮气体,可能有气体生成,故C正确;
D.据以上分析可知,溶液中不能确定是否存在铝离子,故D错误;
故答案选C。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
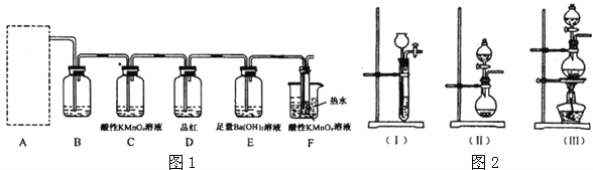
名牌学校分层周周测系列答案【题目】某实验小组用0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸进行中和热的测定,测定稀硫酸和稀氢氧化钠溶液反应的中和热的实验装置如图所示:

(1)仪器A的名称为___。
(2)装置中碎泡沫塑料的作用是___。
(3)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___。
(4)取50mLNaOH溶液和30mL硫酸进行实验,实验数据如下表。
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差 (t2-t1)/℃ | ||
1 | H2SO4 | NaOH | 平均值 | ||
1 | 26.6 | 26.6 | 26.6 | 29.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①温度差平均值为___℃。
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸的密度都是1g·cm-3,中和后生成溶液的比热容c=4.18J·(g·℃)-1。则中和热△H=-53.5kJ/mol。
③上述结果与57.3 kJ·mol-1有偏差,产生此偏差的原因可能是___(填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸的温度