题目内容
【题目】甲、乙两烧杯中各盛有100mL3mol/L的硫酸和氢氧化钠溶液,向两烧杯中分别加入A克的铝粉,反应结束后测得生成的气体体积为甲:乙=3:4,下列说法正确的是( )
A.参加反应的H2SO4为0.2mol B.参加反应的NaOH约为0.27mol
C.加入铝粉的质量A=5.4 D.与硫酸反应的铝粉的质量7.2g
【答案】B
【解析】
试题分析:硫酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,又两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=3:4,设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,
则 2Al+6H+═2Al3++3H2↑
6 3
0.6mol x
![]() =
=![]() ,解得x=0.3mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.3mol×
,解得x=0.3mol,一定条件下,气体的物质的量之比等于体积之比,则碱与金属铝反应生成的氢气的物质的量为0.3mol×![]() =0.4mol,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
=0.4mol,碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,
则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 3
y 0.4mol
![]() =
=![]() ,解得y=
,解得y=![]() mol,则铝的质量为
mol,则铝的质量为![]() ×27g/mol=7.2g,A.酸完全反应,则参加反应的硫酸为0.3mol,故A错误;B.由上述计算可知,参加反应的NaOH
×27g/mol=7.2g,A.酸完全反应,则参加反应的硫酸为0.3mol,故A错误;B.由上述计算可知,参加反应的NaOH![]() ≈0.27mol,故B正确;C.加入铝粉的质量A=7.2,故C错误;D.与硫酸反应的铝粉的质量0.2mol×27g/mol=5.4g,故D错误;故选B。
≈0.27mol,故B正确;C.加入铝粉的质量A=7.2,故C错误;D.与硫酸反应的铝粉的质量0.2mol×27g/mol=5.4g,故D错误;故选B。

【题目】(1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为0.20mol/L的MgCl2和CaCl2混合溶液中逐滴加人Na3P04,先生成___________沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c=____________mol/L。
(2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
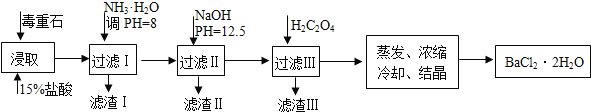
①毒重石用盐酸浸取前需充分研磨,目的是_____________________。
②加入NH3·H2O调节PH=8可除去_____________(填离子符号),滤渣II中含____________(填化学式)。加入H2C2O4时应避免过量,原因是_________________。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)已知25℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,向100mL该条件下的CaSO4饱和溶液中加入400mL0.01mol/LNa2SO4溶液,下列叙述正确的是

A.溶液中析出CaSO4固体沉淀,最终溶液中c(SO42-)比原来的大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO42-)都变小
C.溶液中析出CaSO4固体沉淀.溶液中c(Ca2+)、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)比原来的大