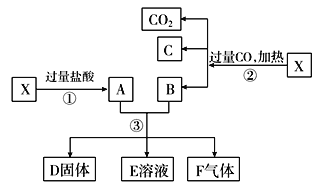
题目内容
【题目】设![]() 为阿伏加德罗常数值。下列有关叙述正确的是
为阿伏加德罗常数值。下列有关叙述正确的是
A.标准状况下,5.6LCO2中含有的共用电子对数目为2NA
B.标准状况下,22.4L苯中含有分子的数目为NA
C.1mol![]() 水解生成的
水解生成的![]() 胶体粒子数为NA
胶体粒子数为NA
D.在反应![]() 中,每生成3mol
中,每生成3mol![]() 转移的电子数为
转移的电子数为![]()
【答案】D
【解析】
A. 1个CO2分子中含有4个共用电子对,标准状况下,5.6LCO2为0.25mol,含有的共用电子对数目为NA,故A错误;
B. 标准状况下,苯为液体,体积不能用于计算粒子数目;故B错误;
C. 一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶体中含有的胶粒的个数小于NA个,故C错误;
D. 在反应![]() 中,生成3mol碘单质转移5mol电子,即转移5NA个,故D正确;
中,生成3mol碘单质转移5mol电子,即转移5NA个,故D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】已知25 ℃时部分弱电解质的电离平衡常数如下表所示:
化学式 | CH3COOH | H2CO3 | HClO | |
平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
回答下列问题:
(1)物质的量浓度均为0.1 mol·L-1的四种溶液:
a. CH3COOH b. H2CO3 c. NaHCO3 d. HClO
pH由小到大的排列顺序是____(填字母)。
(2)常温下,0.1 mol·L-1CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____(填字母)。
A. c(H+) B.![]() C. c(H+)·c(OH-) D.
C. c(H+)·c(OH-) D.![]() E.
E.![]()
(3)体积均为100 mL、pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如下图所示,则HX的电离平衡常数____(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是____。在上述体积、pH均相同的CH3COOH与一元酸HX中加入足量的锌,生成的氢气在相同情况的体积大小关系为:CH3COOH____(填“大于”、“小于”或“等于”)HX

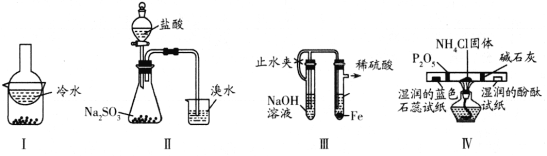
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D