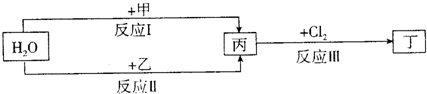
题目内容
有A、B两种常见化合物组成混合物,其焰色反应均为黄色,其相互转化关系如图(其他物质均略去)。
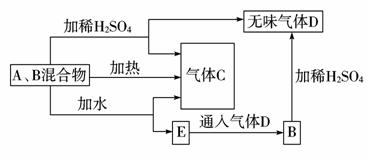
根据以上关系,回答下列问题:
(1)写出A、B、C、D的化学式:A____________,B____________,
C____________,D____________。
(2)写出混合物中加水反应的化学方程式:____________
____________ 。
(3)加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为____________。(填数字)
解析:A、B均为钠的化合物,加热、加水、加酸均能产生气体,加热产生气体C,猜测可能含有碳酸钠或碳酸氢钠,加H2SO42-产生气体C、D,猜测有Na2O2,C为O2,D为CO2,加水后通入CO2生成B,可推测B为NaHCO3,A为Na2O2。加热NaHCO3分解产生的CO2、H2O(g)都能与Na2O2反应,但可认为CO2优先反应: 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
2CO2+2Na2O2=2Na2CO3+O2
要只生成Na2CO3, n(Na2O2)/n(NaHCO3)≤1/2。
答案:(1)Na2O2NaHCO3O2CO2
(2)2Na2O2+2H2O=4NaOH+O2↑ NaOH+NaHCO3=Na2CO3+H2O
(3)1/2

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案现有A、B、C、D四种短周期非金属元素,它们的原子最外层电子数之和为19。在它们的化合物中,主要化合价均不止一种,但都有一种相同的化合价,C的单质常用于太阳能电池。它们的一些物理量如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 单质的沸点/℃ | 444.6 | 4827 | 2355 | –195.8 |
(1)A的元素符号为__________,D元素在周期表第_______周期、第_______族。
(2)在常温下,B与C的最高价氧化物分别为气态和固态,原因是____________________。
(3)含D的两种常见化合物发生化合反应可生成一种离子化合物,该离子化合物撞击时可分解为两种非金属单质和一种化合物,其中一种为D单质,写出该分解反应的化学方程式____________________________________________________________________。
(4)A、B、C、D均能分别形成含18个电子的氢化物,这些氢化物的分子式分别是________________________________________________。
(5)B、D及氢元素中的两种或三种可形成多种含14个电子的化合物,其中空间构型为直线型的是_______________________和_______________________(写结构式)。
 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.
A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族.B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物.