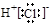题目内容
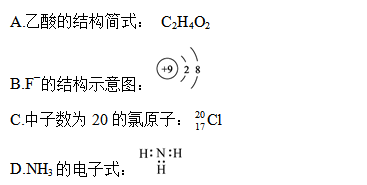
下列反应中转移电子的物质的量不等于2 mol的是
| A.1 mol Al与含1mol H2SO4的稀硫酸溶液反应 |
| B.1mol Cu与含4mol HNO3的稀硝酸溶液反应 |
| C.1 mol MnO2与含2 mol H2O2的双氧水反应 |
| D.1 mol Cu与含2 mol H2SO4的浓硫酸共热 |
D
试题分析:A ,Al与硫酸反应的化学方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑.可见Al过量。反应按照硫酸来计算。硫酸是1mol,所以发生反应转移电子2mol。正确。B.Cu与稀 HNO3反应的化学方程式为: 3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,可见1mol Cu与消耗8/3mol HNO3.。因此硝酸过量。按照Cu来计算。Cu是+2价的金属,1mol的 Cu转移电子2mol。正确。C.1 mol MnO2与含2 mol H2O2的双氧水反应反应的方程式为2H2O2
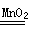 2H2O +O2↑.2 mol H2O2发生分解反应作用电子2mol。正确。D.1 mol Cu与含2 mol H2SO4的浓硫酸共热Cu+2H2SO4(浓)
2H2O +O2↑.2 mol H2O2发生分解反应作用电子2mol。正确。D.1 mol Cu与含2 mol H2SO4的浓硫酸共热Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。1mol的Cu发生反应,消耗2mol的硫酸。随着反应的进行,硫酸变稀,这时反应就不再发生。因此转移电子的物质的量小于2mol。
CuSO4+SO2↑+2H2O。1mol的Cu发生反应,消耗2mol的硫酸。随着反应的进行,硫酸变稀,这时反应就不再发生。因此转移电子的物质的量小于2mol。
练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目