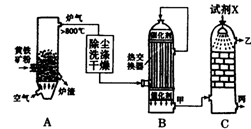
题目内容
某自来水厂利用河水处理成自来水的工艺流程示意图如下图所示:
提供的试剂:饱和Na2CO3溶液、NaOH溶液、生石灰、CC14、BaCl2溶液,KOH溶液
(1)为除水中含有Ca2+、Mg2+、HCO3-、Cl-、SO42-,试剂a代表两种化学物质,主要是除去水中SO42-、Mg2+和HCO3-,这两种试剂是_______和______(只填化学式)。
(2)凝聚剂A常用FeSO4·7H2O,最终生成红褐色胶状沉淀,该胶状沉淀的化学式为______,可以除去其中的悬浮固体颗粒,该过程是______ (填序号)。
A.只有物理变化,无化学变化 B.只有化学变化,无物理变化
C.既有化学变化,又有物理变化
(3)通入CO2的目的是______和______。
(4)传统的氧化剂是Cl2,现代工艺用ClO2取代Cl2,通入CIO2的作用是______,优点是______。
(5)离子交换柱X、Y中有一种是H+型交换柱,另一种是H-型离子交换柱,目的是除去水中残留的杂质离子,则X应是哪种交换柱______(填“H+型”、“OH-型”);如果两个交换柱位置颠倒会产生什么后果____________。
(1)BaCl2 CaO
(2)Fe(OH)3 C
(3)除去Ca2+、调节溶液的pH=4.5;
(4)杀菌、消毒; 高效、强力、无毒、无刺激气味
(5)H+型;如果先通过OH―型离子交换柱,产生的OH―离子会与水体中残留的Ca2+、Mg2+离等作用生成难溶物,而堵塞交换柱。
解析试题解析:(1)除去SO42-可用BaCl2,除去Mg2+和HCO3-,可用生石灰。生石灰与水反应可生成Ca(OH)2。不用NaOH、KOH,这样一方面会增加杂质,另一方面成本较高。
(2)FeSO4·7H2O中的Fe2+在水中会水解生成Fe(OH)2,很容易被水中溶解的O2氧化为Fe(OH)3,因此生成的红褐色胶状沉淀是Fe(OH)3。利用Fe(OH)3胶体的吸附性可除去水中的悬浮固体颗粒,这是物理变化。因此整个过程中化学变化、物理变化都有。
(3)通入CO2一方面可以出去水中Ca2+,另一方面可调节溶液的pH,使铁离子沉淀完全。
(4)通入ClO2是对水进行杀菌、消毒。ClO2与Cl2相比,效率更高,而且无毒、无刺激性气味。
(5)水中残留较多的离子是Ca2+、Mg2+等,若先用OH―型离子交换柱,会生成难溶物,而堵塞交换柱。
考点:考查工艺流程分析,试剂的选择和作用等。

下列叙述中,不符合化学史事实的是( )
| A.法国化学家拉瓦锡建立燃烧现象的氧化学说使近代化学取得了革命性进展 |
| B.英国化学家在世界上首次合成了具有生物活性的蛋白质-------牛胰岛素 |
| C.以碳及其化合物为原料制成的芯片和光导纤维引领我们进入了信息时代 |
| D.经过化学家们的不断努力,从自然界中发现以及人工制造出的化合物已经超过3500万种 |
工业上合成氨的原料之一为氢气,其来源之一是利用石油气的有关成分如丙烷(C3H8)制取。以下途径,假设反应都能进行,从经济效益考虑最合理的反应是( )。
A.C3H8 3C+4H2 3C+4H2 |
B.C3H8 C3H6+H2 C3H6+H2 |
C.C3H8+6H2O 3CO2+10H2 3CO2+10H2 |
D.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |