题目内容
【题目】大力发展电动汽车,可以有效控制空气污染.目前机动车常使用的电池有铅蓄电池、锂电池等.
(1)Ⅰ.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O,锂硫电池充放电的总反应为:2Li+S ![]() Li2S. a.放电时,铅蓄电池的负极反应式为 .
Li2S. a.放电时,铅蓄电池的负极反应式为 .
b.锂硫电池工作时,电子经外电路流向(填“正极”或“负极”).
c.当消耗相同质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的倍.
(2)Ⅱ.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下: 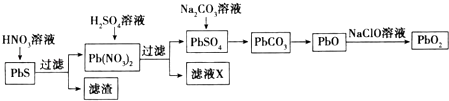 a.油画所用的白色颜料PbSO4置于空气中,遇H2S气体变成黑色PbS,从而使油画的色彩变暗,用H2O2清洗,可使油画“复原”.
a.油画所用的白色颜料PbSO4置于空气中,遇H2S气体变成黑色PbS,从而使油画的色彩变暗,用H2O2清洗,可使油画“复原”.
①H2O2的作用是 .
②已知硫化铅溶于水时存在溶解平衡:PbS(s)Pb2+(aq)+S2﹣(aq),试分析PbS(s)能溶于稀HNO3的原因 .
b.滤液X是一种可循环使用的物质,其溶质主要是(填化学式),若X中残留的SO42﹣过多,循环使用时可能出现的问题是 .
c.①PbO与次氯酸钠溶液反应可制得PbO2 , 写出该反应的离子方程式 .
②以石墨为电极,电解Pb(NO3)2溶液也可以制得PbO2 , 则阳极的电极反应式为;电解时为提高Pb元素的利用率,常在Pb(NO3)2溶液中加入适量Cu(NO3)2 , 理由是 .
【答案】
(1)Pb﹣2e﹣+SO42﹣=PbSO4;正极;4.5
(2)氧化剂;硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;HNO3;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;PbO+ClO﹣=PbO2+Cl﹣;Pb2++2H2O﹣2e﹣=PbO2↓+4H+;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率
【解析】解:(1)a.放电时,铅蓄电池的负极发生氧化反应,而铅离子与溶液中的硫酸根离子生成难溶的硫酸铅,电极反应式为:Pb﹣2e﹣+SO42﹣=PbSO4 , 所以答案是:Pb﹣2e﹣+SO42﹣=PbSO4;b.原电池工作时电子由负极流向正极,所以答案是:正极;c.铅蓄电池中铅是负极,207g铅消耗时转移 2mol e﹣ , 故钠硫电池的理论放电量是铅蓄电池的: ![]() =4.5 倍,所以答案是:4.5;(2)Ⅱ.a.①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂,所以答案是:氧化剂; ②已知硫化铅溶于水时存在溶解平衡:PbS(s)Pb2+(aq)+S2﹣(aq),电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,所以答案是:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
=4.5 倍,所以答案是:4.5;(2)Ⅱ.a.①过氧化氢将黑色PbS氧化成白色的硫酸铅,所以过氧化氢是氧化剂,所以答案是:氧化剂; ②已知硫化铅溶于水时存在溶解平衡:PbS(s)Pb2+(aq)+S2﹣(aq),电离产生的硫离子具有还原性,而硝酸具有强氧化性,发生氧化还原反应,导致硫离子的浓度减少,固平衡正向移动,所以答案是:硝酸氧化硫离子导致硫离子的浓度减小,使溶解平衡正向移动,促进PbS的溶解;
b.硝酸铅与硫酸发生复分解反应生成难溶硫酸铅,和硝酸;残留的SO42﹣过多,会与溶液中的铅离子结合成难溶的硫酸铅,导致铅的流失,减少了二氧化铅的产量,所以答案是:HNO3;浸出时部分铅离子生成硫酸铅随浸出渣排出,降低硫酸铅的产率;
c.①PbO和次氯酸钠反应生成二氧化铅和氯化钠,离子方程式为PbO+ClO﹣=PbO2+Cl﹣;②电解时,阳极上铅离子失电子和水反应生成二氧化铅,电极反应式为Pb2++2H2O﹣2e﹣=PbO2↓+4H+;加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子放电,从而大大提高铅离子的利用率,
所以答案是:PbO+ClO﹣=PbO2+Cl﹣;Pb2++2H2O﹣2e﹣=PbO2↓+4H+ , 加入硫酸铜,铜离子在阴极放电生成单质铜,避免了铅离子在阴极放电,增大铅离子的利用率.

 阅读快车系列答案
阅读快车系列答案