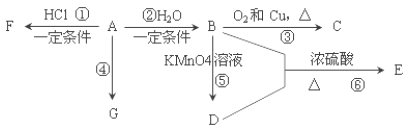
题目内容
【题目】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)![]() 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
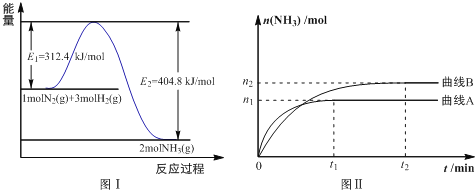
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为![]() mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
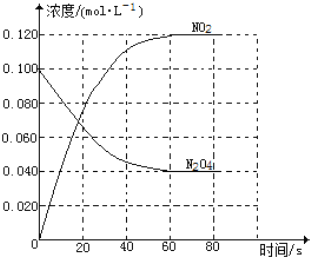
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
【答案】0.01 mol·L-1·min-1 ADEa+c/2= 2,d+3c/2= 72<c<4大于0.001大于c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高逆反应增大压强平衡向气体体积减小的方向移动即逆反应方向-45.5
【解析】
(一)(1)N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始: 1 3 0
变化: x 3x 2x
平衡: 1-x 3-3x 2x
在同温没体积的条件下,气体的物质的量之比等于压强之比,即有![]() ,解得x=0.5,根据化学反应速率的数学表达式,v(N2)=
,解得x=0.5,根据化学反应速率的数学表达式,v(N2)=![]() mol/(L·min)=0.01mol/(L·min);
mol/(L·min)=0.01mol/(L·min);
(2)A、反应物的总能量高于生成物的总能量,即反应为放热反应,△H=(312.4-404.8)kJ·mol-1=-92.4kJ·mol-1,选项A正确;B、催化剂降低活化能,E1降低,选项B错误;C、浓度降低,化学反应速率降低,工业生产时不是反应的浓度越低越好,选项C错误;D、图II曲线A先达到平衡,即TA>TB,选项D正确;E、曲线A中生成NH3的物质的量为n1mol,则消耗N2的物质的量为n1/2mol,根据化学反应速率的定义,v(N2)=n1/4t1mol/(L·min),选项E正确;答案选ADE;
(3)恒温恒容时,构成等效平衡,转化到同一半边,投入量与原平衡投入量相等,即a+c/2=2,b+3c/2=7,要想开始时从逆反应方向开始,c的最大值应为4mol,但a、b、c均不为0,则c<4,
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
起始: 2 7 0
变化: x 3x 2x
平衡: 2-x 7-3x 2x 相同条件下,压强之比等于物质的量之比,![]() ,解得x=1。欲使反应向逆反应方向进行,则c>2,综上所述,c的取值范围是2<c<4;
,解得x=1。欲使反应向逆反应方向进行,则c>2,综上所述,c的取值范围是2<c<4;
(二)(1)根据题意,温度升高,混合气体颜色变深,说明升高温度,平衡向正反应方向进行,即△H大于0;根据化学反应速率的数学表达式,v(N2O4)=![]() =0.001mol/(L·s);
=0.001mol/(L·s);
(2)c(N2O4)降低平衡正向移动,正反应为吸热反应,故温度升高,即T大于100℃;
(3)减少容积,压强增大,平衡向逆反应方向移动,原因是增大压强平衡向气体体积减小的方向移动即逆反应方向;
(4)①2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1,
②2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1,
③CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1,根据目标反应方程式,推出①-②-③得出△H=(-23.9+29.1-50.7)kJ·mol-1=-45.5kJ·mol-1。

 阅读快车系列答案
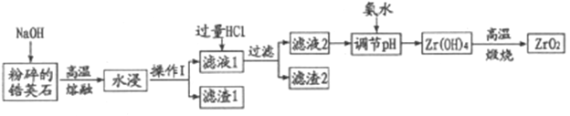
阅读快车系列答案【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D