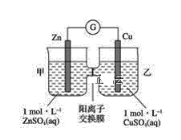
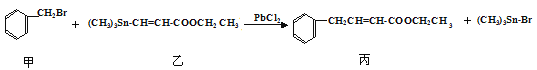
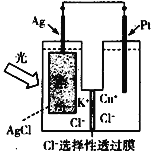
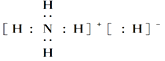题目内容
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的2L稀硝酸,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入2.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法正确的是( )
A. Cu与Cu2O的物质的量之比为1∶1
B. 硝酸的物质的量浓度为1 mol·L-1
C. 产生的NO的体积为4.48 L
D. Cu、Cu2O与硝酸反应后剩余HNO3为1.2 mol
【答案】D
【解析】
n[Cu(OH)2]=![]() =0.4mol。A,64g/moln(Cu)+144g/moln(Cu2O)=27.2g,根据Cu守恒,n(Cu)+2n(Cu2O)=0.4mol,解得n(Cu)=0.2mol,n(Cu2O)=0.1mol,Cu与Cu2O物质的量之比为2:1,A项错误;B,根据得失电子守恒,3n(HNO3)被还原=2n(Cu)+2n(Cu2O)=2
=0.4mol。A,64g/moln(Cu)+144g/moln(Cu2O)=27.2g,根据Cu守恒,n(Cu)+2n(Cu2O)=0.4mol,解得n(Cu)=0.2mol,n(Cu2O)=0.1mol,Cu与Cu2O物质的量之比为2:1,A项错误;B,根据得失电子守恒,3n(HNO3)被还原=2n(Cu)+2n(Cu2O)=2![]() 0.2mol+2
0.2mol+2![]() 0.1mol=0.6mol,n(HNO3)被还原=0.2mol,加入NaOH溶液金属离子完全沉淀时所得溶液中溶质为NaNO3,根据Na、N守恒,与HNO3反应后溶液中n(NO3-)=n(NaOH)=2mol/L
0.1mol=0.6mol,n(HNO3)被还原=0.2mol,加入NaOH溶液金属离子完全沉淀时所得溶液中溶质为NaNO3,根据Na、N守恒,与HNO3反应后溶液中n(NO3-)=n(NaOH)=2mol/L![]() 1L=2mol,原HNO3溶液中HNO3物质的量为0.2mol+2mol=2.2mol,HNO3物质的量浓度为
1L=2mol,原HNO3溶液中HNO3物质的量为0.2mol+2mol=2.2mol,HNO3物质的量浓度为![]() =1.1mol/L,B项错误;C,HNO3被还原成NO,n(NO)=0.2mol,由于NO所处温度和压强未知,不能用22.4L/mol计算NO的体积,C项错误;D,根据电荷守恒,与HNO3反应后溶液中n(NO3-)=2n(Cu2+)+n(H+)剩余=2mol,n(H+)剩余=2mol-2
=1.1mol/L,B项错误;C,HNO3被还原成NO,n(NO)=0.2mol,由于NO所处温度和压强未知,不能用22.4L/mol计算NO的体积,C项错误;D,根据电荷守恒,与HNO3反应后溶液中n(NO3-)=2n(Cu2+)+n(H+)剩余=2mol,n(H+)剩余=2mol-2![]() 0.4mol=1.2mol,Cu、Cu2O与HNO3反应后剩余HNO3为1.2mol,D项正确;答案选D。
0.4mol=1.2mol,Cu、Cu2O与HNO3反应后剩余HNO3为1.2mol,D项正确;答案选D。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案