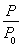题目内容
化工生产中常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是________(填物质名称)。
(2)“三酸”与“两碱”之间的反应,若用化学方程式表示有六个(酸过量时) ,若用离子方程式表示却只有两个,请写出这两个离子方程式:(酸过量时)_____________________________、______________________。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是________。
A.Au B.Cu
C.Al D.Fe
(4)烧碱、纯碱溶液均可吸收CO2,当含0.1 mol NaOH的溶液吸收一定量CO2后,将溶液低温小心蒸干得到固体的组成可能有四种情况,分别是(填化学式):
①________,②Na2CO3,③________,④NaHCO3。
(1)纯碱 (2)CO+2H+=CO2↑+H2O OH-+H+=H2O (3)B (4)①NaOH、Na2CO3 ③Na2CO3、NaHCO3
【解析】本题考查了物质的分类、离子方程式的书写及有关的化学计算等。(1)纯碱的成分是Na2CO3,属于盐而不属于碱;(2)烧碱(NaOH)与“三酸”反应的离子方程式为:OH-+H+=H2O;纯碱(Na2CO3)与“三酸”反应的离子方程式为:CO+2H+=CO2↑+H2O;(3)Au与浓HNO3不反应;Fe、Al常温下遇浓HNO3发生“钝化”;Cu常温下可完全溶于足量浓HNO3。(4)依据CO2与NaOH溶液发生反应:CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,判断另两种情况为:NaOH、Na2CO3,Na2CO3、NaHCO3。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案一定温度下,容积为2 L的甲、乙两固定容积的密闭容器中,发生反应:2SO2(g)+O2(g)  2SO3(g)。达平衡时测得有关数据如下表。
2SO3(g)。达平衡时测得有关数据如下表。
容器 | 甲 | 乙 |
反应物投入量 | 2 mol SO2、1 mol O2 | 4 mol SO3 |
n(SO3)/mol | 1.6 | a |
反应物的转化率 | α1 | α2 |
下列说法正确的是( )。
A.α1+α2>1
B.1.6<a<3.2
C.若甲中反应2 min时达到平衡,则2 min 内平均速率v(O2)=0.2 mol·L-1·min-1
D.甲平衡后再加入0.2 mol SO2、0.2 mol O2和0.4 mol SO3,平衡正向移动