题目内容
若1.8 g某金属跟足量盐酸充分反应,放出2.24 L(标准状况)氢气,则该金属是( )
| A.Al | B.Mg | C.Fe | D.Zn |
A
本题主要考查了金属与酸反应,同时考查了相关计算,应注意抓住金属的通性,同时要考虑到各自的特性。常见的金属如Mg、Al也是考查的重点知识。正确写出金属与酸反应的化学方程式,根据方程式进行计算,或根据电子守恒求金属的摩尔质量。
解法一:根据反应方程式,分别计算出1.8 g四种金属跟足量HCl反应放出的H2,与2.24 L比较,只有Al符合,所以选择A。
解法二:设金属的摩尔质量为M,化合价为n,根据电子守恒有 ×n=
×n=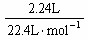 ×2,
×2, 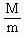 =9g·
=9g·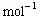 。故本题答案为A。
。故本题答案为A。
解法一:根据反应方程式,分别计算出1.8 g四种金属跟足量HCl反应放出的H2,与2.24 L比较,只有Al符合,所以选择A。
解法二:设金属的摩尔质量为M,化合价为n,根据电子守恒有
 ×n=
×n=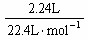 ×2,
×2, 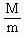 =9g·
=9g·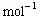 。故本题答案为A。
。故本题答案为A。
练习册系列答案
相关题目