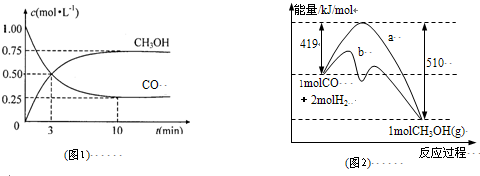
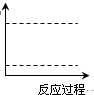
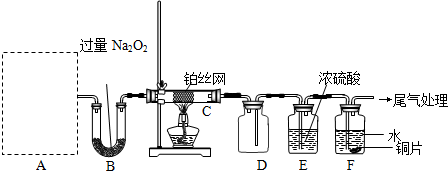
题目内容
下列对于Na2O2的叙述中,正确的是( )
| A、Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物 | B、Na2O2能与水反应,所以Na2O2可以作气体干燥剂 | C、Na2O2与水反应时,Na2O2是氧化剂,水是还原剂 | D、Na2O2与二氧化碳反应时,Na2O2既是氧化剂又是还原剂 |
分析:A、过氧化钠属于过氧化物;
B、过氧化钠可以和水反应生成氧气,干燥气体时会引入氧气;
C、根据过氧化钠和水反应时化合价的变化来回答;
D、根据过氧化钠和二氧化碳反应时化合价的变化来回答.
B、过氧化钠可以和水反应生成氧气,干燥气体时会引入氧气;
C、根据过氧化钠和水反应时化合价的变化来回答;
D、根据过氧化钠和二氧化碳反应时化合价的变化来回答.
解答:解:A、Na2O2能与酸反应生成盐、水和氧气,过氧化钠属于过氧化物,故A错误;
B、过氧化钠可以和水反应生成氧气,如果用它来干燥气体时会引入氧气,不能做气体干燥剂,故B错误;
C、过氧化钠和水的反应为:2Na2O2+2H2O=4NaOH+O2,化合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故C错误;
D、过氧化钠和二氧化碳的反应为:2Na2O2+2CO2=2Na2CO3+O2,合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故D正确.
故选D.
B、过氧化钠可以和水反应生成氧气,如果用它来干燥气体时会引入氧气,不能做气体干燥剂,故B错误;
C、过氧化钠和水的反应为:2Na2O2+2H2O=4NaOH+O2,化合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故C错误;
D、过氧化钠和二氧化碳的反应为:2Na2O2+2CO2=2Na2CO3+O2,合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故D正确.
故选D.
点评:本题结合过氧化钠的性质来考查学生氧化还原反应的知识,要求学生具有分析和解决问题的能力,难度不大.

练习册系列答案
相关题目