题目内容
下列变化能用同一性质解释的有( )
①浓硫酸和浓盐酸在空气中敞口放置时浓度均减小;②二氧化硫和氯气均能使品红溶液褪色;③二氧化硫能使品红溶液、溴水褪色;④氨气和碘化氢气体均不能用浓硫酸干燥;⑤常温下浓硫酸用铁制的容器存放、加热条件下浓硫酸能与木炭反应⑥浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字;⑦二氧化碳、二氧化硫使澄清石灰水变浑浊
A.1个 B.2个 C.3个 D.5个
B
【解析】
试题分析:①浓硫酸是靠吸水性,浓盐酸是靠易挥发性;②二氧化硫是通过和有色物质结合使其褪色,加热后可逆,而氯气是依靠强氧化性与有色物质反应使其褪色,加热后不可逆;③使品红褪色是利用其漂白性,使溴水褪色是利用其还原性;④浓硫酸不可干燥碘化氢是因为浓硫酸具有强氧化性,而不可干燥氨气是因为它的酸性;⑤都是浓硫酸的强氧化性;⑥浓硫酸的脱水性,氢氟酸可以和二氧化硅反应;⑦都是发生化学反应生成沉淀。所以B正确。
考点:化学物质的性质。

 阅读快车系列答案
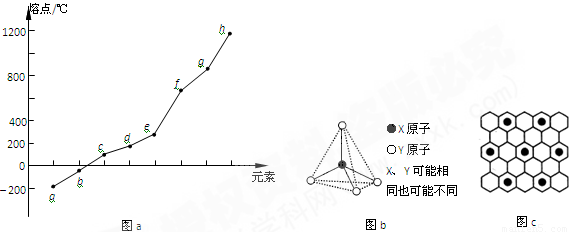
阅读快车系列答案元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33.35 | 164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
(11分)某化学兴趣小组的同学设计了一套实验方案探究元素周期表中元素性质的变化规律:1、同一周期内从左到右元素金属性的递变规律;
2、同一主族内从上到下元素非金属性的递变规律。
| 实验方法(Ⅰ) | 实验现象(Ⅱ) |
| 1.钠与冷水反应,再向反应后溶液中滴加酚酞。 | A.产生白烟 |
| 2.向新制的H2S饱和溶液中滴加新制的氯水 | B.反应不十分剧烈,产生的气体能燃烧,溶液变成浅红色。与酸反应剧烈,产生大量气泡且可以燃烧 |
| 3.镁带用砂纸打磨后在空气中燃烧 | C.产生大量气泡、气体可以燃烧 |
| 4.NaI溶液中加入溴水和CCl4 | D.下层溶液变橙色 |
| 5.镁带用砂纸打磨后与沸水反应,再向反应后溶液中滴加酚酞。镁带用砂纸打磨后与2mol/L盐酸反应。 | E.浮于水面,熔成小球,迅速向四处游动,溶液变成红色 |
| 6.蘸浓氨水与浓盐酸的两玻璃棒接近 | F.下层溶液变紫色 |
| 7.NaBr溶液中加入氯水和CCl4 | G.发出耀眼的强光,生成白色物质 |
| 8.铝片用砂纸打磨后与2mol/L盐酸反应 | H.生成淡黄色沉淀 |
(1) 从上表(Ⅰ)中选择实验方法,从(Ⅱ)中选择相应的实验现象,上下对应地填写符合要求的答案在空格中(有几个填几个,不一定把空格填满)。
| | 探究同一周期从左到右元素金属性的递变规律 | 探究同一主族内从上到下元素非金属性的递变规律 | ||||||
| Ⅰ | | | | | | | | |
| Ⅱ | | | | | | | | |
元素的金属性: ,元素的非金属性: 。
(3)上表(Ⅰ)中实验方法8反应的离子方程式
(4)上表(Ⅱ)中实验现象D反应的离子方程式
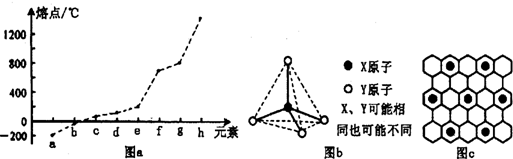
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33.35 |
164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。