题目内容
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
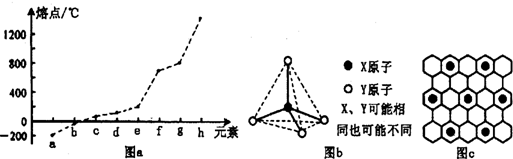
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33.35 |
164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
(1)H2O H2O分子间可以形成氢键 角型或折线型
(2)CH4 Si
(3)30
(4)石墨 KC6
【解析】

(1)短周期元素中,原子最外层电子数和电子层数相等的元素有________种。
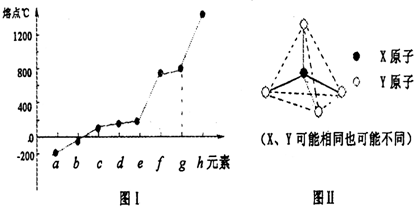
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为________________;第三周期元素单质的熔点(℃)变化如下图Ⅰ所示,其中h的元素符号为________________。
氢化物 | 沸点/℃ |
A | 1 317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |
表1

图Ⅰ
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图Ⅱ所示。请写出甲、乙反应的离子方程式_________________。

(X、Y可能相同也可能不同)
图Ⅱ
(4)第二、第三周期的某些元素中能形成具有图Ⅱ所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为__________g。
氢化物 | 沸点 |
A | 1317 |
B | 100 |
C | 19.5 |
D | -33 |
E | -162 |

(1)短周期元素中,原子的最外层电子数与电子层数相等的元素有__________种;
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,则A的晶体类型是__________;C与D发生反应的化学方程式为_________________________;
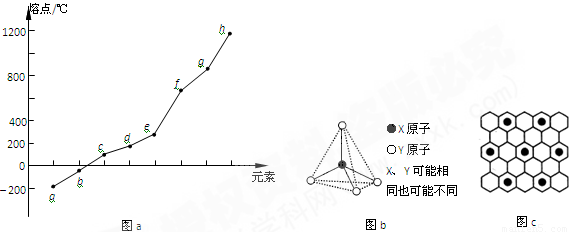
(3)第三周期元素单质的熔点按由低到高排列如图Ⅰ所示,则g元素的名称为__________,写出工业上冶炼h的化学方程式______________________________;
(4)分子甲和离子乙含有相等的电子数,且离子乙的立体结构如图Ⅱ所示,写出乙离子在甲中发生反应的离子方程式_______________________________。