题目内容
5.向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
| A. | a点对应的溶液中:NH${\;}_{4}^{+}$、Fe3+、SO${\;}_{4}^{2-}$、HCO${\;}_{3}^{-}$ | |
| B. | b点对应的溶液中:K+、Na+、NO${\;}_{3}^{-}$、Cl- | |
| C. | c点对应的溶液中:Na+、K+、SO${\;}_{4}^{2-}$、OH- | |
| D. | d点对应的溶液中:Ca2+、NH4+、I-、H+ |
分析 A.a点没有生成氢氧化铝沉淀,加入的偏铝酸钠不足,溶液中存在大量氢离子,碳酸氢根离子与铁离子、氢离子反应;
B.b点偏铝酸根离子恰好与氢离子反应生成铝离子,四种离子之间不反应,都不与铝离子反应;
C.c点氢氧化铝沉淀达到最大,氢氧根离子与氢氧化铝反应;
D.d点为偏铝酸钠过量,氢离子与偏铝酸根离子反应.
解答 解:A.a点加入的偏铝酸钠溶液不足,溶液中盐酸过量,溶液显示酸性,Fe3+、HCO3-发生双水解反应,HCO3-与氢离子反应,在溶液中不能大量共存,故A错误;
B.b点偏铝酸钠与溶液中氢离子恰好反应生成AlCl3,K+、Na+、NO3-、Cl-之间不反应,都不与氢离子反应,在溶液中能大量共存,故B正确;
C.c点生成氢氧化铝沉淀恰好达到最大量,氢氧化铝与OH-离子反应,在溶液中不能大量共存,故C错误;
D.d点加入了过量的偏铝酸钠,溶质为NaCl和NaAlO2,偏铝酸钠与H+反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意掌握离子反应发生条件,明确离子共存的判断方法,正确分析a、b、c、d中溶质的组成为解答本题的关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
15.实验测得常温下0.1mol/L某一元酸(HA)溶液的pH不等于l,0.1mol/L某一元碱(BOH)溶液里:c(H+)=10-13.将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1mol•L-1氨水溶液:K+、Na+、NO3-、AlO2- | |
| B. | 0.1mol•L-1Fe(NO3)2溶液:H+、Al3+、SO42-、Cl- | |
| C. | 滴入酚酞显红色的溶液:Na+、Mg2+、NO3-、HSO3- | |
| D. | 由水电离出的c(H)=10-11mol•L-1的溶液:Ca2+、NH4+、Cl-、HCO3- |
13.氯气和水反应生成HCl和HClO,欲从反应混合物中分离出HClO溶液,下列方法可选用的是( )
| A. | 加硫酸钙,充分反应后蒸馏 | B. | 加碳酸钙,充分反应后蒸馏 | ||
| C. | 加磷酸钙,充分反应后蒸馏 | D. | 加氯化钙,充分反应后蒸馏 |
20.pH=11的X、Y两种碱溶液各5mL,分别稀释至500mL,其pH随溶液体积(V)变化的关系如图所示,下列说法正确的是( )
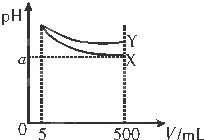

| A. | 稀释后X溶液中水的电离程度比Y溶液中水的电离程度小 | |
| B. | 若X、Y是一元碱,等物质的量浓度的盐酸盐溶液,Y的pH大 | |
| C. | 若X、Y都是一元弱碱,则a的值一定大于9 | |
| D. | 完全中和X、Y两溶液时,消耗同浓度稀硫酸的体积:V(X)>V(Y) |
1.在一定条件下,将N2和H2按体积比1:3混合充入某密闭容器中,发生反应:N2+3H2?2NH3.当反应在平衡时,恢复到原温度和压强下,测得NH3的体积分数为40%,则N2在平衡混合体系中的体积分数为( )
| A. | 15% | B. | 20% | C. | 30% | D. | 40% |
5.卧室、林荫小道、电影院的空气属于( )
| A. | 化合物 | B. | 单质 | C. | 混合物 | D. | 纯净物 |
6.下列说法中正确的是( )
| A. | S-诱抗素的分子结构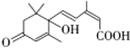 中含有苯环、羟基、羰基、羧基(提示: 中含有苯环、羟基、羰基、羧基(提示: 是羰基) 是羰基) | |
| B. | 1mol阿司匹林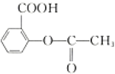 可与2molNaOH发生反应 可与2molNaOH发生反应 | |
| C. | 食品香精菠萝酯的生产路线(反应条件略去)如下图,步骤(2)产物中残留的烯丙醇可用溴水检验: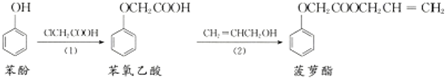 | |
| D. | 有机物A为茉莉香型香料.已知 ,则A的分子式为C14H18O ,则A的分子式为C14H18O |