题目内容
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1mole-时生成1mol白色沉淀 |
| C.通入SO2时,SO2与I2反应,I2作还原剂 |
| D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,向反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI.
A、由上述分析及化学方程可知,白色沉淀是CuI,溶液中含有I2,故A错误;
B、CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,由方程式可知每转移2mol电子生成
2molCuI,所以转移1mole-时生成1molCuI白色沉淀,故B正确;
C、反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI,由反应可知,碘元素化合价由0价降低为-1价,被还原,所以I2是氧化剂,故C错误;
D、2CuSO4+4KI═2K2SO4+2CuI↓+I2反应中Cu2+化合价降低是氧化剂,I2是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:Cu2+>I2,SO2+2H2O+I2=H2SO4+2HI中碘元素化合价由0价降低为-1价,I2是氧化剂,SO2被氧化,所以物质氧化性I2>SO2,所以氧化性Cu2+>I2>SO2,故D正确.
故选:BD.
A、由上述分析及化学方程可知,白色沉淀是CuI,溶液中含有I2,故A错误;
B、CuSO4溶液中逐滴加入KI溶液化学方程式为2CuSO4+4KI═2K2SO4+2CuI↓+I2,由方程式可知每转移2mol电子生成
2molCuI,所以转移1mole-时生成1molCuI白色沉淀,故B正确;
C、反应后的混合物中不断通入SO2气体,反应方程式:SO2+2H2O+I2=H2SO4+2HI,由反应可知,碘元素化合价由0价降低为-1价,被还原,所以I2是氧化剂,故C错误;
D、2CuSO4+4KI═2K2SO4+2CuI↓+I2反应中Cu2+化合价降低是氧化剂,I2是氧化产物,氧化剂的氧化性强于氧化产物的氧化性,所以物质的氧化性:Cu2+>I2,SO2+2H2O+I2=H2SO4+2HI中碘元素化合价由0价降低为-1价,I2是氧化剂,SO2被氧化,所以物质氧化性I2>SO2,所以氧化性Cu2+>I2>SO2,故D正确.
故选:BD.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
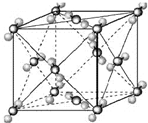 (2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
(2009?宿迁模拟)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中B、D、E原子最外电子层的p能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示.原子序数为31的元素镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaE为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.