题目内容
【题目】某课外活动小组同学用如图装置进行实验,试回答下列问题
①若开始时开关K与a连接,则铁发生电化学腐蚀中的腐蚀.
②若开始时开关K与b连接,则总反应的离子方程式为 . 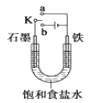
【答案】吸氧;2H2O+2Cl﹣ ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
【解析】解:(1)开始时开关K与a连接,是原电池,铁为负极,发生氧化反应,失去电子生成亚铁离子,电极方程式为Fe﹣2e﹣=Fe2+ , A极上氧气得电子被还原,电极方程式为O2+2H2O+4e﹣=4OH﹣ , 为铁的吸氧腐蚀;
所以答案是:吸氧;(2)开关K与b连接,装置为电解池,铁为阴极,发生还原反应,氢离子得到电子生成氢气,电解饱和食盐水生成氢氧化钠、氢气和氯气,总反应式为2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,2H2O+2Cl﹣
2NaOH+H2↑+Cl2↑,2H2O+2Cl﹣ ![]() H2↑+Cl2↑+2OH﹣;
H2↑+Cl2↑+2OH﹣;
所以答案是:2H2O+2Cl﹣ ![]() H2↑+Cl2↑+2OH﹣ .
H2↑+Cl2↑+2OH﹣ .
【考点精析】解答此题的关键在于理解金属的电化学腐蚀与防护的相关知识,掌握金属的保护:涂保护层;保持干燥;改变金属的内部结构,使其稳定;牺牲阳极的阴极保护法即用一种更为活泼的金属与要保护的金属构成原电池;外加电源法.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】汽车尾气是造成雾霾天气的原因之一.
(1)汽车尾气中含有CO、NO2等有毒气体对汽车加装尾气净化装置可使有毒气体相互反应转化为无毒气体. 写出该反应的热化学方程式 .
N2(g)+2O2(g)═2NO2(g)△H=+68.0kJmol﹣1;
2C(s)+O2(g)═2CO(g)△H=﹣221.0kJmol﹣1;
C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
(2)汽车尾气中含有CO和H2O(g)在一定条件下可以发生反应
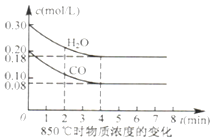
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.850℃在体积为10L反应器中通入一定量的CO和H2O(g)发生上述反应CO和H2O(g)的浓度变化如图所示则0﹣4min是平均反应速率v(H2O)=此时K= .
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
850℃在甲、乙、丙三个1L的恒容密闭容器中,起始时按照表进行投料,达到平衡状态.平衡时甲容器中CO的转化率是 . 比较下列容器中CO的转化率甲乙(填“大于”、“<”或“等于”).