题目内容
某反应是放热反应,所放出的热能从何而来?某反应是吸热反应,且所吸收的热能由外加热源(如酒精灯)提供,提供的热能主要起什么作用?
答案:略
解析:
解析:
|
答案:放热反应中,反应物的总能量大于生成物的总能量,当反应物变为生成物时,放出的热能就是两者的能量差.吸热反应中反应物的总能量小于生成物的总能量,当反应物变为生成物时同时吸收外加热源的热能转化为生成物的总能量的一部分. 解析:化学反应过程遵循能量守恒定律.化学反应过程中放出或吸收的热量就等于反应物总能量与生成物总能量的差值. |

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
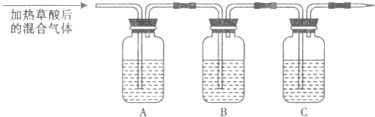
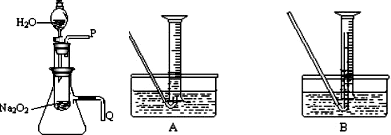 (2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
(2008?枣庄一模)化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
