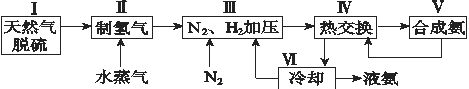
题目内容
【题目】明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
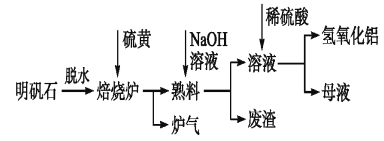
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S![]() 2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是___________;若生成1 mol Al2O3,则转移的电子数为__________________。
(2)熟料溶解时,反应的离子方程式为________________。
(3)母液中溶质主要成分为__________。(填化学式)
(4)检验废渣中主要成分的方法:
①操作__________________________,
②现象__________________________,
③结论__________________________。
【答案】(1)Al2(SO4)3;3.612×1024(写6NA也给分)
(2)Al2O3+2OH-=2AlO2-+H2O(3)K2SO4、Na2SO4
(4)①操作:取少量废渣于试管,加入适量稀硫酸(或稀酸),溶解后滴加KSCN溶液②现象:溶液变红色③结论:废渣中含有Fe2O3
【解析】
试题分析:(1)根据方程式可知,反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,得到2个电子,发生还原反应,所以Al2(SO4)3是氧化剂。反应中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×![]() =1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。
=1.5mol,所以转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024。
(2)氧化铝是两性氧化物,能溶于氢氧化钠溶液中,所以由工艺流程可知,熟料溶解为氧化铝与氢氧化钠溶液反应生成偏铝酸钠,反应离子方程式为Al2O3+3H2O+2OH-=2[Al(OH)4]-。
(3)由工艺流程可知,熟料溶解所得的溶液中含有K+、Na+、SO42-、[Al(OH)4]-、OH-等,加硫酸调pH值,[Al(OH)4]-转化为Al(OH)3沉淀而析出,母液中离子主要有K+、Na+、SO42-,因此含有溶质为K2SO4、Na2SO4。
(4)由工艺流程可知,废渣的主要成分为Fe2O3,可以通过检验铁离子来检验氧化铁。即取少量废渣,加入适量盐酸溶解,再滴加KSCN溶液,若溶液被红色,说明废渣中含有Fe2O3。