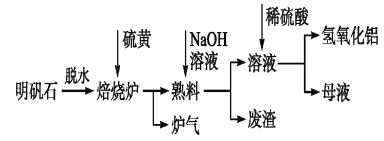
题目内容
【题目】下列依据热化学方程式得出的结论不正确的是( )
A.由C(s,石墨)═C(s,金钢石) △H>0可知,金刚石比石墨稳定
B.CO(g)燃烧热是283.0kJmol﹣1,则2CO2(g)═2CO(g)+O2(g)△H=+566.0kJmol﹣1
C.CH4(g)+2O2(g)═CO2+2H2O(I)△H<0,该反应的化学能可以转化为电能
D.已知C(s)+O2(g)═CO2(g)△H1,C(s)+![]() O2(g)═CO(g)△H2,则△H1<△H2
O2(g)═CO(g)△H2,则△H1<△H2
【答案】A
【解析】
试题分析:A、由C(石墨,s)═C(金钢石,s)△H>0,石墨转化为金刚石吸热,说明石墨的能量低于金刚石的能量,能量越低越稳定,故A错误;B、燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,反应焓变符号随之变化,系数加倍焓变随之加倍,CO的标准燃烧热是△H=-283.0KJ/mol,CO(g)+![]() O2(g)=CO2(g)△H=-283.0KJ/mol/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol,故B正确;C、反应是氧化还原反应,可以设计成原电池,将该反应的化学能可以转化为电能,故C正确;D、碳完全燃烧放出的热量多,且反应热为负值,所以C(s)+O2(g)═CO2(g)△H1,C(s)+
O2(g)=CO2(g)△H=-283.0KJ/mol/mol,则反应2CO2(g)═2CO(g)+O2(g)的△H=+566.0KJ/mol,故B正确;C、反应是氧化还原反应,可以设计成原电池,将该反应的化学能可以转化为电能,故C正确;D、碳完全燃烧放出的热量多,且反应热为负值,所以C(s)+O2(g)═CO2(g)△H1,C(s)+![]() O2(g)═CO(g)△H2,则△H1<△H2,故D正确;故选A。
O2(g)═CO(g)△H2,则△H1<△H2,故D正确;故选A。

练习册系列答案
相关题目