题目内容
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应,在第5s时,NO的转化率为____。
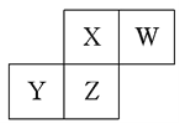
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~2s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
【答案】是; 65%; b; ![]() ; bc。
; bc。
【解析】
(1)根据表中数据,NO的浓度随时间延长,浓度不再变化,且没有完全反应,所以反应为可逆反应;在第5s时,NO反应了0.013mol,则转化率为![]() =65%;
=65%;
(2)根据一氧化氮物质的量的变化,同一时间内,NO减少的量等于NO2增加的量,所以表示NO2变化曲线的是b;在0~2s内,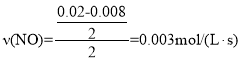
则该反应的O2平均速率![]()
(3)a.无法判断正逆反应速率是否相等,则a错误;
b.反应前后气体体积不同,压强不变,说明正逆反应速率相等,各组分浓度不变,则b正确;
c. v逆(NO)=2v正(O2),说明正逆反应速率相等,反应达到平衡,c正确;
d.恒容容器内,反应物生成物都是气体,气体质量不变,所以密度不变不能判断平衡,d错误,
综上能说明该反应已达到平衡状态的是bc。

 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】氯化铁是常见的水处理剂,利用废铁屑可制备无水氯化铁。实验室制备装置和工业制备流程图如下:
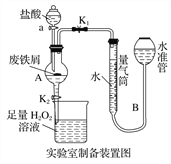
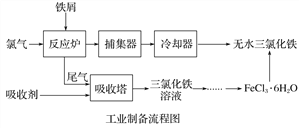
已知:(1)无水FeCl3的熔点为555 K、沸点为588 K。
(2)废铁屑中的杂质不与盐酸反应。
(3)不同温度下六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 20 | 80 | 100 |
溶解度(g/100 g H2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
Ⅰ.打开弹簧夹K1,关闭活塞K2,并打开活塞a,缓慢滴加盐酸;
Ⅱ.当……时,关闭弹簧夹K1,打开活塞K2,当A中溶液完全进入烧杯后关闭活塞a;
Ⅲ.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
(1)烧杯中足量的H2O2溶液的作用是_____________________________。
(2)为了测定废铁屑中铁的质量分数,操作Ⅱ中“…”的内容是______________。
(3)从FeCl3溶液制得FeCl3·6H2O晶体的操作步骤是加入______________后__________________、过滤、洗涤、干燥。
(4)试写出吸收塔中反应的离子方程式:______________________。
(5)捕集器温度超过673 K时,存在相对分子质量为325的铁的氯化物,该物质的分子式(相对原子质量:Cl-35.5、Fe-56)为____________。
(6)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,配制成100 mL溶液;取出10.00 mL,加入稍过量的KI溶液,充分反应后,滴入几滴淀粉溶液,并用c mol·L-1 Na2S2O3溶液滴定,消耗V mL(已知:I2+2S2O32-=2I-+S4O62-)。
①滴定终点的现象是________________________________________________;
②样品中氯化铁的质量分数为__________________________。
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | -2 | -3 | -1 | -3 |
(1)⑧号元素在周期表中的位置是____;上述元素处于同一主族的有____。(用元素符号表示)
(2span>)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式:____。
(3)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() Li和
Li和![]() Li作核反应堆最佳热载体,
Li作核反应堆最佳热载体,![]() LiH和
LiH和![]() LiD用作高温堆减速剂。下列说法正确的是____。
LiD用作高温堆减速剂。下列说法正确的是____。
A.![]() Li和
Li和![]() Li互为同位素 B.
Li互为同位素 B.![]() Li和
Li和![]() Li属于同种核素
Li属于同种核素
C.![]() LiH和
LiH和![]() LiD的化学性质不同 D.
LiD的化学性质不同 D.![]() LiH和
LiH和![]() LiD是同种物质
LiD是同种物质
②下列说法不正确的是____。
A.碱性:Be(OH)2<LiOH<NaOH<KOH
B.半径:K>Na>Li>Li+
C.氧化性:Li+<Na+<K+<Rb+<Cs+
D.金属性:Cs>Rb>K>Na>Li>Be