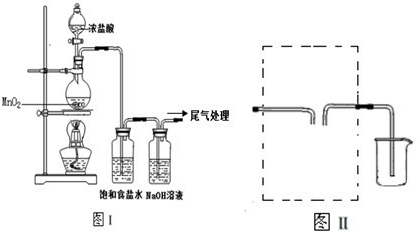
题目内容
在室温下,NaCl在水中的溶解度是36 g。以石墨作阳极对饱和食盐水进行电解,化学反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
回答下列问题:
(1)电解一段时间后,欲使食盐水恢复到原来的状态,下列做法合理的是_________。
A.向电解后的溶液中通适量HCl气体
B.向电解后的溶液中加适量浓盐酸
C.将电解后的溶液先分离出NaOH,再加入NaCl
D.将电解后的溶液先分离出NaOH,再加入水
E.向电解后的溶液中先加入适量的MgCl2,搅拌后再过滤
(2)在以上合理的做法中,最适宜应用于工业生产的是_________________。
解析:由上述“使电解后的电解质溶液恢复原状的措施(3)”可知A合理、B不合理。饱和NaCl溶液中NaCl与H2O的质量比为36∶100=9∶25,被电解的NaCl与H2O的质量比为58.5∶18,电解、分离出NaOH后的溶液是不饱和NaCl溶液,因此C合理,D不合理。加MgCl2后发生反应MgCl2+2NaOH====Mg(OH)2↓+2NaCl,这虽然使NaCl的总量恢复了原状,但H2O的总量未恢复原状,因此E不合理。
NaOH是电解饱和食盐水的主要产品之一,将其分离出来以后,再将稀NaCl溶液加NaCl后重复应用,这是工业生产中的理想措施之一。虽然通适量HCl气体能使NaCl溶液恢复原状,但这是以工业生产的高级产品制备低级原料的逆行措施,不可取。
答案:(1)AC (2)C

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
 飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为:
飞机、汽车、拖拉机、坦克,都是用蓄电池作为照明光源是典型的可充型电池,总反应式为: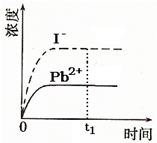 ④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.
④已知室温下PbI2的Ksp=8.0×10-9,将适量PbI2固体溶于 100mL水中至刚好饱和,该过程中Pb2+和I-浓度随时间变化关系如图(饱和PbI2溶液中c(I-)=0.0025mol?L-1).若t1时刻在上述体系中加入100mL.、0.020mol?L-1 NaI 溶液,画出t1时刻后Pb2+和I-浓度随时间变化关系图.