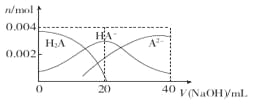
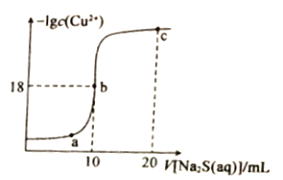
题目内容
【题目】一定温度下,在一容积不变的密闭容器中发生的可逆反应2X(g)![]() Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
Y(g)+Z(s),以下不能作为反应达到平衡标志的是( )
A.v正(X)=2v逆(Y)B.混合气体的压强不再变化
C.混合气体的密度不再变化D.单位时间内生成lmolY的同时分解2mol X
【答案】D
【解析】
A选项,v正(X)正向反应,v逆(Y)逆向反应,速率比等于计量系数比,能作为反应达到平衡标志,故A不符合题意;
B选项,反应是体积减小的反应,当混合气体的压强不再变化,说明反应达到平衡状态,能作为反应达到平衡标志,故B不符合题意;
C选项,密度等于气体质量除以容器体积,从左到右气体质量减少,容器体积不变,密度减小,当混合气体的密度不再变化,能作为反应达到平衡标志,故C不符合题意;
D选项,单位时间内生成lmolY是正向,同时分解2mol X也是正向,不能作为反应达到平衡标志,故D符合题意。
综上所述,答案为D。

【题目】废旧锂离子电池的正极材料试样![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通过下列实验方法回收钴、锂.
可通过下列实验方法回收钴、锂.
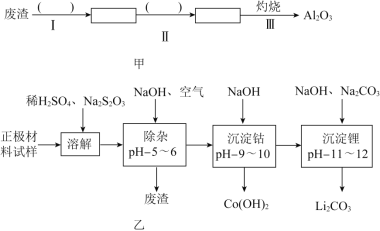
(1)在上述溶解过程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解过程中反应的离子方程式为 ______ .
在溶解过程中反应的离子方程式为 ______ .
沉淀物 | 开始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除杂时通入空气的目的 ______ ,所得的废渣成分为 ______ ![]() 从废渣中获得
从废渣中获得![]() 的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有 ______ ,步骤Ⅱ中反应的离子方程式是 ______ .
(3)工业上,将![]() 粗品制备成高纯
粗品制备成高纯![]() 的部分工艺如图乙.
的部分工艺如图乙.
![]() 将
将![]() 溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
![]() 电解后向LiOH溶液中加入过量
电解后向LiOH溶液中加入过量![]() 溶液,过滤、烘干得高纯
溶液,过滤、烘干得高纯![]() .
.
①![]() 中,阴极的电极反应式是 ______ .
中,阴极的电极反应式是 ______ .
②![]() 中,生成
中,生成![]() 反应的化学方程式是 ______ .
反应的化学方程式是 ______ .
【题目】下列实验中,对应的现象以及解释或结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 解释或结论 |
A | 向足量的浓硝酸中加入铁片,一段时间后加入铜粉 | 有气体生成,溶液呈蓝绿色 | 浓硝酸将Fe氧化为 |
B | 分别向 | 均有白色沉淀产生 | 金属性: |
C | 表面变黑的银器浸泡到盛有食盐水的铝制容器中,银器与铝接触 | 银器变得光亮如新 | 构成原电池,铝做负极,硫化银得电子被还原成单质银 |
D | 向 | 白色沉淀逐渐变为浅蓝色 |
|
A.AB.BC.CD.D