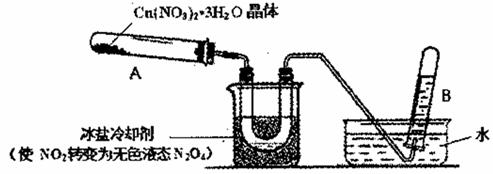
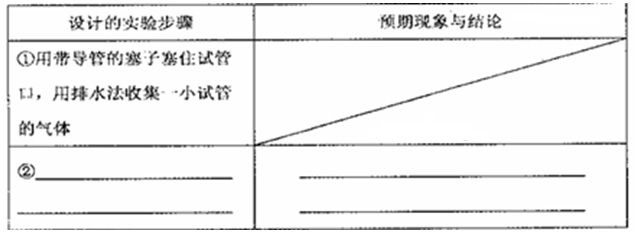
题目内容
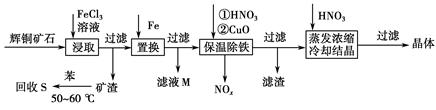
硫铁矿烧渣是一种重要的化工生产中间产物,主要成分是Fe3O4、Fe2O3、FeO和二氧化硅等。下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁的流程图:
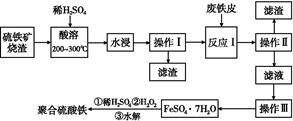
(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。

(1)实验室实现“操作Ⅰ”所用的玻璃仪器有 、玻璃棒和烧杯。“操作Ⅲ”系列操作名称依次为 、 、过滤和洗涤。
(2)“酸溶”过程中Fe3O4溶解的化学反应方程式为 。
(3)硫铁矿烧渣在“酸溶”前要粉碎的主要目的是 。
(4)实验室检验“反应Ⅰ”已经完全的试剂是 ,现象是 。
(5)加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式: 。
(1)漏斗 蒸发浓缩 冷却结晶
(2)Fe3O4+4H2SO4 FeSO4+Fe2(SO4)3+4H2O
FeSO4+Fe2(SO4)3+4H2O
(3)增大烧渣与硫酸的接触面积,加快烧渣的溶解
(4)KSCN溶液 溶液不呈红色
(5)2Fe2++H2O2+2H+ 2Fe3++2H2O
2Fe3++2H2O
(2)Fe3O4+4H2SO4
 FeSO4+Fe2(SO4)3+4H2O
FeSO4+Fe2(SO4)3+4H2O(3)增大烧渣与硫酸的接触面积,加快烧渣的溶解
(4)KSCN溶液 溶液不呈红色
(5)2Fe2++H2O2+2H+
 2Fe3++2H2O
2Fe3++2H2O(1)根据流程图可知,操作Ⅰ为过滤,需要的玻璃仪器有漏斗、玻璃棒、烧杯。操作Ⅲ的目的是由溶液得到晶体FeSO4·7H2O,故需蒸发浓缩、冷却结晶。
(2)Fe3O4和H2SO4发生复分解反应生成FeSO4、Fe2(SO4)3。
(3)将固体粉碎能增大接触面积,加快反应。
(4)反应Ⅰ为:Fe+2Fe3+ 3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。
3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。
(5)H2O2作氧化剂时其还原产物为H2O。
(2)Fe3O4和H2SO4发生复分解反应生成FeSO4、Fe2(SO4)3。
(3)将固体粉碎能增大接触面积,加快反应。
(4)反应Ⅰ为:Fe+2Fe3+
 3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。
3Fe2+,取清液,用KSCN溶液检验不显红色,从而确认Fe3+反应完全。(5)H2O2作氧化剂时其还原产物为H2O。

练习册系列答案
相关题目