题目内容
1.92 g Cu片与一定量的浓HNO3作用,当收集到NO2和NO气体共1.12 L(标准状况)时,金属铜恰好全部反应,则反应中消耗HNO3___________________mol,被还原的HNO3_______________________mol,转移电子_________________________mol。
9.0.11 0.05 0.06
n(e-)=n(Cu)×2=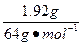 ×2="0.06" mol
×2="0.06" mol
n被还原(HNO3)=n(NO2)+n(NO)=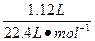 ="0.05" mol
="0.05" mol
n总(HNO3)=n(Cu)×2+n(NO)+n(NO2)="0.06" mol+0.05 mol="0.11" mol
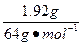 ×2="0.06" mol
×2="0.06" moln被还原(HNO3)=n(NO2)+n(NO)=
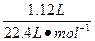 ="0.05" mol
="0.05" moln总(HNO3)=n(Cu)×2+n(NO)+n(NO2)="0.06" mol+0.05 mol="0.11" mol

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目

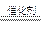 NF3+3NH4F
NF3+3NH4F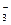 +cH+
+cH+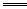 dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是 (用一个代数式表示。下同)。?
dFe2++fFe3++g NO↑+hN2O↑+kH2O(化学计量数均为正整数)。回答下列问题:(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得c、g、h的关系式是 (用一个代数式表示。下同)。?