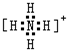题目内容
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体是一种重要的半导体材料。下列说法中,正确的是
- A.X、M两种元素形成的化合物的晶体中一定含有离子键,不可能含有共价键
- B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
- C.元素Y、Z、W的单质晶体的熔点高低顺序为:Y>Z>W
- D.化合物ZW2的分子空间构型为直线形
C
试题分析:Y的单质晶体是一种重要的半导体材料,所以Y是硅元素。则根据离子的电荷数可知,X是钠。又因为X+与M2-具有相同的电子层结构,所以M是氧元素,则根据Z、M同主族可知,Z是S元素。离子半径:Z2->W-,所以W是氯元素。A不正确,过氧化钠中含有非极性键;B不正确,水分之间存在氢键,沸点最高;硅是原子晶体、S单质和氯气都是分子晶体,所以选项C正确;化合物ZW2的分子中S原子含有2对孤电子对数,其空间构型为V形,D不正确,答案选C。
考点:考查元素周期表的结构和元素周期律的应用
点评:本题属于位、构、性的综合考查,需要熟练掌握元素周期表的结构,然后结合已知的条件逐一推断即可。
试题分析:Y的单质晶体是一种重要的半导体材料,所以Y是硅元素。则根据离子的电荷数可知,X是钠。又因为X+与M2-具有相同的电子层结构,所以M是氧元素,则根据Z、M同主族可知,Z是S元素。离子半径:Z2->W-,所以W是氯元素。A不正确,过氧化钠中含有非极性键;B不正确,水分之间存在氢键,沸点最高;硅是原子晶体、S单质和氯气都是分子晶体,所以选项C正确;化合物ZW2的分子中S原子含有2对孤电子对数,其空间构型为V形,D不正确,答案选C。
考点:考查元素周期表的结构和元素周期律的应用
点评:本题属于位、构、性的综合考查,需要熟练掌握元素周期表的结构,然后结合已知的条件逐一推断即可。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A、X、M两种元素只能形成X2M型化合物 | B、Y、Z两元素的气态氢化物中,Y的气态氢化物更稳定 | C、Z、W两元素的最高价氧化物对应水化物的酸性:Z>W | D、W、M两元素的某些单质或化合物可作为自来水消毒剂 |