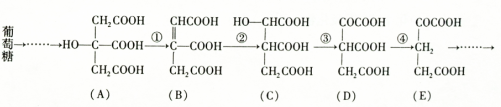
题目内容
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按下图所示连接好装置进行实验,以制取乙酸乙酯。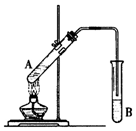
(1)试管B中盛放的试剂是 (填名称),实验时往往在B试管中可以看到少量气泡,写出与此现象对应的离子方程式 。
(2)乙醇与乙酸反应的化学方程式是 。
(3)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若要分离B中的液体混合物需要用到的玻璃仪器是 。
(4)用30g乙酸与46g乙醇反应,如果实验产率是理论产率的60%,则可得到的产物质量是 g。
(5)某同学采用“CH3CH218OH”做该实验,结果含18O原子的产物的结构简式为 ,乙酸分子的官能团名称为 ,乙酸在反应中被取代的原子团的电子式为 。
(1)饱和Na2CO3溶液;2CH3COOH+CO32- → 2CH3COO- +CO2↑+H2O。
(2)CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
(3)分液漏斗。 (4)26.4 (5)CH3COOCH2CH3;羧基;
解析试题分析:(1)试管B中盛放的试剂是饱和Na2CO3溶液,其作用是溶解乙醇,反应消耗乙酸,降低乙酸乙酯的溶解度,便于分层析出。实验时往往在B试管中可以看到少量气泡,该反应的两种方程式为2CH3COOH+CO32- → 2CH3COO- +CO2↑+H2O。(2)乙醇与乙酸在浓硫酸作催化剂时发生反应的化学方程式是CH3COOH+CH3CH2OH  CH3COOCH2CH3+H2O。(3)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若要分离B中的互不相溶的两层液体混合物需要用到的玻璃仪器是是分液漏斗。(4)n(乙酸)=0.5mol,n(乙醇)=1mol乙醇过量所以产生的乙酸乙酯按照乙酸来计算如果实验产率是理论产率的60%,则可得到的产物的质量为0.5mol×60%×88g/mol=26.4g。(5)某同学采用“CH3CH218OH”做该实验,由于酯化反应的脱水方式是酸脱羟基醇脱氢。所以含18O原子的产物的结构简式为CH3COOCH2CH3。乙酸在反应中被取代的原子团羧基的羟基的电子式为
CH3COOCH2CH3+H2O。(3)实验完成后,试管B的液面上有透明的不溶于水的油状液体产生。若要分离B中的互不相溶的两层液体混合物需要用到的玻璃仪器是是分液漏斗。(4)n(乙酸)=0.5mol,n(乙醇)=1mol乙醇过量所以产生的乙酸乙酯按照乙酸来计算如果实验产率是理论产率的60%,则可得到的产物的质量为0.5mol×60%×88g/mol=26.4g。(5)某同学采用“CH3CH218OH”做该实验,由于酯化反应的脱水方式是酸脱羟基醇脱氢。所以含18O原子的产物的结构简式为CH3COOCH2CH3。乙酸在反应中被取代的原子团羧基的羟基的电子式为 。
。
考点:考查酯化反应的原理、操作、仪器的使用、计算及化学方程式的书写的知识。

糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是
| A.植物油不能使溴的四氯化碳溶液褪色 |
| B.淀粉水解的最终产物是葡萄糖 |
| C.葡萄糖能发生水解和氧化反应 |
| D.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
【有机物化学基础】
对羟基苯甲醛,俗称PHBA,是-种重要的有机化工原料。其结构如图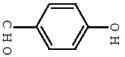 所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
所示。有人提出,以对甲基苯酚为原料合成PHBA的途径如下:
(1)PHBA的官能团的名称为_______。
(2)下有关PHBA的说法正确的是_______。
| A.PHBA的分子式为C7H6O2 |
| B.PHBA是一种芳香烃 |
| C.1mol PHBA最多能与4mo1 H2反应 |
| D.PHBA能与NaHCO3溶液反应生成CO2 |
(4)反应③的化学方程式为_______。
(5)该合成途径中的反应①⑤的作用为_______。
(6)E有多种同分异构体,符合以下所有特征的同分异构体的结构简式为______ (只写一种)。
a.苯环上存在2种不同化学环境的氢原子,且个数比为1:2
b.遇FeCl3溶液显示特征颜色
c.能使溴的四氯化碳溶液褪色


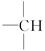 ,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。
,且是天然蛋白质水解的最终产物之一,则该同分异构体的结构简式为_____________________________________。