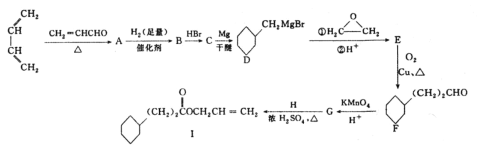
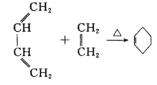
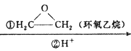
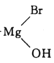
题目内容
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。在500℃下合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g),在1 L 的密闭容器中,充入1 mol CO2和3 mol H2,压强为p0 ,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
①反应进行到4 min 时,υ(正)__ (填“>”“<”或“=”)υ(逆)。0~4 min,H2的平均反应速率υ(H2)=__ mol·L-1·min-1。
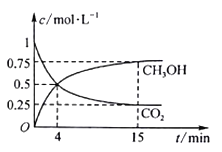
②CO2平衡时的体积分数为_____,该温度下Kp为_____(用含有p0的式子表示)。
【答案】> 0.375 10% ![]()
【解析】
①根据反应正在建立得到正逆反应速率关系,再根据变化量得到速率。
②根据三段式建立关系,得到体积分数和压强平衡常数。
①根据图示,反应进行到4 min 后,甲醇的物质的量继续增大,反应正向进行,υ(正) >υ(逆);0~4 min,甲醇的浓度变化为0.5 mol/L,H2的浓度变化为1.5mol/L,![]() ,故答案为:>;0.375。
,故答案为:>;0.375。
②根据图示,15min 时达到平衡状态,CO2的平衡浓度为0.25mol/L,则
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L) 1 3 0 0
转化(mol/L) 0.75 2.25 0.75 0.75
平衡(mol/L) 0.25 0.75 0.75 0.75
CO2平衡时的体积分数为![]() 10%;根据压强比等于气体物质的量比,平衡时的总压强为
10%;根据压强比等于气体物质的量比,平衡时的总压强为![]() ,
,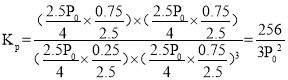 ,故答案为:10%;
,故答案为:10%;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式____________.
(2)B元素在周期表中的位置____________;离子半径:B____________A(填“大于”或“小于”).原子半径:B____________C(填“大于”或“小于”).
(3)C原子的电子排布图是____________,其原子核外有____________个未成对电子,能量最高的电子为____________轨道上的电子,其轨道呈____________形.
(4)D﹣的结构示意图是____________.第一电离能D____________A(填“大于”或“小于”).
(5)C单质中的化学键为____________(填“极性键”或“非极性键”),1molC的气态氢化物中含有____________molσ键。