题目内容
设阿伏加德罗常数(NA)的数值为NA,下列说法正确的是( )
| A、1mol Cl2与足量Fe反应,转移的电子数为3NA |
| B、1.5mol NO2与足量H2O反应,转移的电子数为1.5NA |
| C、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
| D、0.10mol Fe粉与足量水蒸气反应生成的H2分子数为0.10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.氯气与铁反应生成氯化铁,铁少量,氯气完全反应,转化为氯离子;
B.3NO2+H2O=2HNO3十NO,反应中二氧化氮既做氧化剂,又做还原剂,消耗3molNO2,转移2mol电子;
C.NO2和N2O4,具有相同的最简式为NO2;
D.铁与水蒸气反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2↑,消耗3mol铁生成4mol氢气.
B.3NO2+H2O=2HNO3十NO,反应中二氧化氮既做氧化剂,又做还原剂,消耗3molNO2,转移2mol电子;
C.NO2和N2O4,具有相同的最简式为NO2;
D.铁与水蒸气反应的化学方程式为:3Fe+4H2O(g)
| ||
解答:
解:A.1mol Cl2与足量Fe反应,转移的电子数为2NA,故A错误;
B.3NO2+H2O=2HNO3十NO,反应中二氧化氮既做氧化剂,又做还原剂,消耗3molNO2,转移2mol电子,所以1.5mol NO2与足量H2O反应,转移的电子数为1.5NA转移的电子数为1NA,故B错误;
C.NO2和N2O4,具有相同的最简式为NO2,46g的NO2和N2O4混合气体含有的原子数为
×3×NA=3NA,故C正确;
D.铁与水蒸气反应的化学方程式为:3Fe+4H2O(g)
Fe3O4+4H2↑,消耗3mol铁生成4mol氢气,
3 4
0.10mol
mol
所以0.10mol Fe粉与足量水蒸气反应生成的H2分子数为
NA,
故选:C.
B.3NO2+H2O=2HNO3十NO,反应中二氧化氮既做氧化剂,又做还原剂,消耗3molNO2,转移2mol电子,所以1.5mol NO2与足量H2O反应,转移的电子数为1.5NA转移的电子数为1NA,故B错误;
C.NO2和N2O4,具有相同的最简式为NO2,46g的NO2和N2O4混合气体含有的原子数为
| 46g |
| 46g/mol |
D.铁与水蒸气反应的化学方程式为:3Fe+4H2O(g)
| ||
3 4
0.10mol
| 0.4 |
| 3 |
所以0.10mol Fe粉与足量水蒸气反应生成的H2分子数为
| 0.4 |
| 3 |
故选:C.
点评:本题考查了阿伏伽德罗常数的应用,熟悉使用阿伏伽德罗常数的注意事项是解题关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定条件下,将0.1L CO、0.2L CO2、0.1L NO、0.2L NO2和0.2L NH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定).假设气体通过每个洗气瓶都能充分反映,则尾气(已干燥)( )
| A、不可能是单一气体 |
| B、不可能含有一氧化碳 |
| C、可能存在原气体中的两种气体 |
| D、成分与洗气瓶的排列顺序无关 |
下列表述正确的是( )
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6.
①浓硝酸通常保存在棕色试剂瓶中
②检验亚硫酸钠溶液在空气中放置是否变质可以先加硝酸溶液,再加氯化钡溶液来检验
③锌与稀硝酸反应可以得到氢气
④浓硫酸滴到纸张上变黑,说明浓硫酸具有吸水性
⑤二氧化硫和二氧化氮都能形成酸雨,酸雨的pH等于5.6.
| A、①③ | B、①② | C、① | D、①②④⑤ |
下列与有机物结构、性质相关的叙述错误的是( )
A、乙醛和丙烯醛(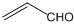 )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 |
B、一分子β-月桂烯(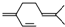 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 |
C、用甘氨酸(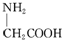 )和丙氨酸( )和丙氨酸(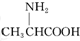 )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 |
D、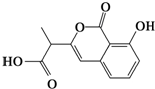 和 和 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
下列物质均易溶于水,但其纯物质分子间不能形成氢键的是( )
| A、HCHO |
| B、CH3OH |
| C、CH3COOH |
| D、HF |
下列实验现象的描述错误的是( )
| A、氢气在氯气中燃烧产生苍白色火焰 |
| B、红热的铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒 |
| C、红热的铜丝在氯气中燃烧,产生棕黄色烟 |
| D、钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体 |
分子式为C4H7O2Br的有机物能与碳酸氢钠溶液反应产生气体,该有机物的结构可能有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
为除去括号内的杂质,所选用的试剂或方法不正确的是( )
| A、NaHCO3溶液(Na2CO3溶液)通入过量的CO2 |
| B、铁粉(铝粉)加入适量的NaOH溶液过滤 |
| C、Na2CO3溶液(Na2SO4溶液)加入适量的Ba(OH)2溶液过滤 |
| D、CO2(CO)将混合气体通过足量灼热的CuO |