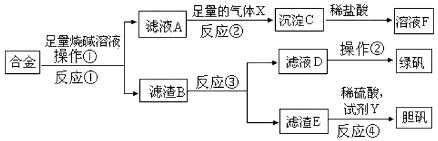
题目内容
【题目】A,B,C,D,E,F是元素周期表中前四周期元素,且原子序数依次增大,其相关信息如下: ①A的周期序数等于其主族序数;
②B、D原子的L层中都有两个未成对电子;
③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn﹣1;
④F原子有四个能层,K、L、M全充满,最外层只有一个电子.
试回答下列问题:
(1)基态E原子中,电子占据的最高能层符号为 , F的价层电子排布式为 .
(2)B,C,D的电负性由大到小的顺序为(用元素符号填写),C与A形成的分子CA3的VSEPR模型为 .
(3)B和D分别与A形成的化合物的稳定性:BA4小于A2D,原因是 .
(4)以E,F的单质为电极,组成如图1所示的装置,E极的电极反应式为 . 
(5)向盛有F的硫酸盐FSO4的试管里逐滴加入氨水,首先出现蓝色沉淀,继续滴加氨水,蓝色沉淀溶解,得到深蓝色溶液,再向深蓝色透明溶液中加入乙醇,析出深蓝色晶体.蓝色沉淀溶解的离子方程式为 .
(6)F的晶胞结构(面心立方)如图2所示:已知两个最近的F的距离为acm,F的密度为g/cm3(阿伏伽德罗常数用NA表示,F的相对原子质量用M表示) 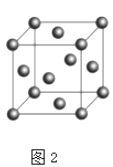
【答案】
(1)M;3d104s1
(2)O>N>C;正四面体
(3)H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4
(4)Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O
(5)Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣或Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH﹣+4H2O
(6)![]()
【解析】解:①A的周期序数等于其主族序数,则A为H元素;②B,D原子的L层中都有两个未成对电子,且B原子序数小于D,则B是C,D是O,则C是N元素;③E元素原子最外层电子排布式为(n+1)Sn(n+1)Pn﹣1 , n=2,则E为Al元素;④F原子有四个能层,K、L、M全充满,最外层只有一个电子,则F为Cu元素;(1)E是Al元素,最高的能层是第三电子层,为M层;F是Cu元素,其原子核外3d、4s电子为其价电子,所以其价电子排布式为3d104s1 , 所以答案是:M;3d104s1;(2)B,C,D分别是C,N,O元素,同一周期元素,元素电负性随着原子序数增大而增大,所以这三种元素电负性大小顺序是O>N>C;
N与H形成的分子NH3 , 氨气分子中N共用电子对个数是3、孤电子对数是1,所以N原子价层电子对个数是4,其VSEPR模型是正四面体结构,
所以答案是:O>N>C;正四面体;(3)氢化物的稳定性与化学键的键能及非金属的非金属性强弱有关,化学键的键能越大、非金属的非金属性越强,其氢化物越稳定,H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4 , 所以答案是:H2O中共价键的键能高于CH4中共价键的键能或非金属性O大于C,气态氢化物的稳定性H2O大于CH4;(4)Al、Cu和NaOH溶液构成的原电池中,Al易失电子作负极、Cu作正极,负极上Al失电子和氢氧根离子反应生成偏铝酸根离子和水,电极反应式为Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O,所以答案是:Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O;(5)一水合氨和硫酸铜反应生成Cu(OH)2沉淀,氢氧化铜能和氨气反应生成铜铵络离子而使氢氧化铜溶解,则蓝色沉淀溶解离子方程式为Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣或Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O,所以答案是:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣或Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O;(6)该晶胞中Cu原子个数=8× ![]() +6×
+6× ![]() =4,每个面中心上的原子到顶点的原子距离最小,两个最近的F的距离为acm,则晶胞的棱长=
=4,每个面中心上的原子到顶点的原子距离最小,两个最近的F的距离为acm,则晶胞的棱长= ![]() acm,晶体密度=
acm,晶体密度= ![]() =
= ![]() g/cm3=
g/cm3= ![]() g/cm3 ,
g/cm3 ,
所以答案是: ![]() .
.

【题目】下列物质的分类正确的是( )
酸 | 碱 | 盐 | 氧化物 | |
A | H2SO4 | Na2CO3 | CaCl2 | H2O |
B | 硝酸 | 烧碱 | 小苏打NaHCO3 | 干冰 |
C | NaHSO4 | 铜绿Cu2(OH)2CO3 | 生石灰 | 熟石灰 |
D | CO2 | 氢氧化铜 | 氯化铵 | 生石灰 |
A. A B. B C. C D. D