题目内容
在一定体积的18mol/L的浓H2SO4中加入过量铜片,加热使之反应,被还原的H2SO4为0.9mol,则浓H2SO4的实际体积为( )
分析:铜只能和浓硫酸反应,而与稀硫酸不反应,由Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O可知,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则18mol?L-1的浓硫酸的实际体积要大于理论计算值,以此来解答.
| ||
解答:解:铜只能和浓硫酸反应,而与稀硫酸不反应,随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,当被还原的硫酸是0.9mol,则
由Cu+2H2SO4(浓)
CuSO4+SO2↑+H2O可知,
2 1
1.8mol 0.9mol
理论消耗浓硫酸为
=0.1L=100mL,
则实际体积大于100mL,
故选D.
由Cu+2H2SO4(浓)
| ||
2 1
1.8mol 0.9mol
理论消耗浓硫酸为
| 1.8mol |
| 18mol/L |
则实际体积大于100mL,
故选D.
点评:本题考查浓硫酸的性质,注意稀硫酸与Cu不反应为解答的关键,把握发生的化学反应及浓度的计算即可解答,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
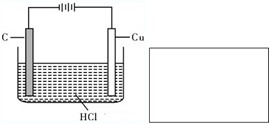 盐酸、硫酸和硝酸是中学常见的三种酸.
盐酸、硫酸和硝酸是中学常见的三种酸.