题目内容
 盐酸、硫酸和硝酸是中学常见的三种酸.
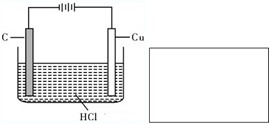
盐酸、硫酸和硝酸是中学常见的三种酸.(1)通常条件下,铜与稀盐酸不反应.但在如下两种情况下能发生:
①向稀盐酸中加入H2O2后,铜发生溶解.写出此反应的化学方程式:
Cu+H2O2+2HCl═CuCl2+2H2O
Cu+H2O2+2HCl═CuCl2+2H2O
;②如图,阳极的反应式
Cu-2e-═Cu2+
Cu-2e-═Cu2+
,总反应的化学方程式是Cu+2HCl
CuCl2+H2↑
| ||
Cu+2HCl
CuCl2+H2↑
.
| ||
(2)①写出铜和浓硝酸反应的化学方程式:
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O
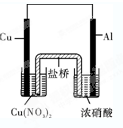
;②试用此反应设计成原电池,提供的仪器和试剂有:铜片、铝片、浓硝酸、硝酸铜溶液、盐桥、小烧杯2个.请在方框中画出所设计的原电池的简图(要求在图中标出烧杯中的溶液和电极材料的名称)

③此原电池正极的气体生成物是
NO2
NO2
.(3)在一定体积的18mol/L的浓硫酸中加入过量的铜片,加热使之反应,化学方程式是:Cu+2H2SO4(浓)
| ||
大于
大于
100mL(选填“大于”或“小于”).分析:(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化;用电解原理实现铜和盐酸的反应,铜应作电解池的阳极;
(2)①铜和浓硝酸反应反应硝酸铜和NO;
②铝与浓硝酸发生钝化反应,铜、铝以及浓硝酸组成的原电池中,铜为原电池的负极,电解质溶液分别为硝酸铜和浓硝酸;
③正极发生还原反应生成二氧化氮气体;
(3)根据稀硫酸与铜不反应的性质进行判断.
(2)①铜和浓硝酸反应反应硝酸铜和NO;
②铝与浓硝酸发生钝化反应,铜、铝以及浓硝酸组成的原电池中,铜为原电池的负极,电解质溶液分别为硝酸铜和浓硝酸;
③正极发生还原反应生成二氧化氮气体;
(3)根据稀硫酸与铜不反应的性质进行判断.
解答:解:(1)①双氧水具有氧化性,在酸性环境下能将金属铜氧化,反应的化学方程式为Cu+H2O2+2HCl═CuCl2+2H2O,
故答案为:Cu+H2O2+2HCl═CuCl2+2H2O;
②因铜与盐酸不反应,可用电解的方法完成,电解时,Cu作阳极,发生Cu-2e-═Cu2+,阴极上生成氢气,反应的总反应式为Cu+2HCl
CuCl2+H2↑,故答案为:Cu-2e-═Cu2+;Cu+2HCl
CuCl2+H2↑;
(2)①铜和浓硝酸反应反应硝酸铜和NO,反应的方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
②铜、铝以及浓硝酸组成的原电池中,铜为原电池的负极,电解质溶液分别为硝酸铜和浓硝酸,可设计为 ,
,
故答案为: ;
;
③浓硝酸在正极发生还原反应生成NO2,故答案为:NO2;
(3)浓硫酸和铜反应生成二氧化硫,随着反应的进行硫酸的浓度逐渐降低,则稀硫酸和铜不反应,所以被还原的硫酸为0.9mol.浓硫酸的实际体积大于100mL,故答案为:大于.
故答案为:Cu+H2O2+2HCl═CuCl2+2H2O;
②因铜与盐酸不反应,可用电解的方法完成,电解时,Cu作阳极,发生Cu-2e-═Cu2+,阴极上生成氢气,反应的总反应式为Cu+2HCl
| ||
| ||
(2)①铜和浓硝酸反应反应硝酸铜和NO,反应的方程式为Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2,
故答案为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
②铜、铝以及浓硝酸组成的原电池中,铜为原电池的负极,电解质溶液分别为硝酸铜和浓硝酸,可设计为
 ,
,故答案为:
 ;
;③浓硝酸在正极发生还原反应生成NO2,故答案为:NO2;
(3)浓硫酸和铜反应生成二氧化硫,随着反应的进行硫酸的浓度逐渐降低,则稀硫酸和铜不反应,所以被还原的硫酸为0.9mol.浓硫酸的实际体积大于100mL,故答案为:大于.
点评:本题考查了铜和酸反应的实验设计,难点是(2)题,注意根据物质的性质和题目要求设计原电池和电解池反应,设计实验是高考的热点,也是学习的难点.

练习册系列答案
相关题目
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:

