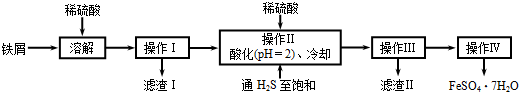
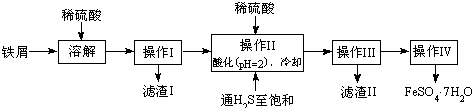
题目内容
20 ℃时H2S饱和溶液1 L,其浓度为0.1 mol·L-1,其电离方程式为:H2SA.加入适量的水 B.加入适量的NaOH固体
C.加入适量的SO2 D.加入适量的CuSO4固体
解析:本题考查H2S电离平衡问题。A项加水将H2S饱和溶液稀释,各种粒子浓度都减小,故不符合题意。B项加NaOH时,中和了体系中的H+,平衡右移,使S2-浓度增大,不符合题意。C项加入适量的SO2后发生如下反应:2H2S+SO2====3S↓+2H2O,使c(H2S)减小,上述平衡左移,H+、S2-浓度均减小,不符合题意。D项加入适量的CuSO4固体后,由于Cu2+与S2-结合成CuS沉淀,使S2-浓度减小,平衡右移,则H+浓度增大。
答案:D

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目