题目内容
【题目】外围电子排布式为3d104s1的元素在周期表中应位于( )
A. 第四周期ⅠB族 B. 第五周期ⅡB族
C. 第四周期ⅦB族 D. 第五周期ⅢB族
【答案】A
【解析】根据该元素的外围电子排布,得出其电子层数为4,因此它位于第四周期。由于3d轨道上为全充满结构,得出该元素位于ds区,又因为最外层4s轨道上有1个电子,因此它位于ⅠB族。

 阅读快车系列答案
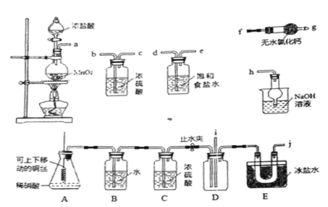
阅读快车系列答案【题目】足量锌与浓H2SO4充分在加热下反应生成会SO2和H2的混合气体;锌和稀硫酸反应只有H2生成。现有甲乙两研究小组分别实验探究:
(1)甲研究小组按下图实验验证锌与浓硫酸反应生成物中SO2和H2,取少量的Zn置于b中,向a中加入100mL18.5mol·L-1的浓硫酸,经过一段时间反应,Zn完全溶解
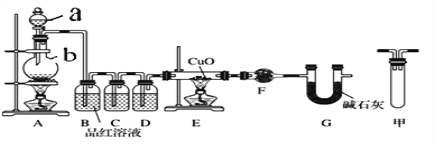
①填写仪器名称:a_____________、b_________。
②写出装置A中生成能使品红溶液褪色的化学反应方程式:_________________。
③装置D中加入的试剂是__________。
④U型管G的作用为______________。
⑤有同学认为A、B间应增加图中的甲装置,该装置的作用为__________。
⑥证明反应生成SO2和H2的实验现象是_________________。
⑦若A中生成标准状况下的气体33.6L,将A反应后的溶液稀释到1L,测得溶液中H+的浓度为0.1 mol·L-1,则稀释液中SO42-的物质的量浓度是_________ mol·L-1。
(2)乙研究小组为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
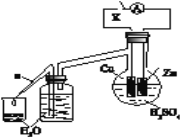
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是形成原电池反应速度快。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_____________________________________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是:_______。