题目内容
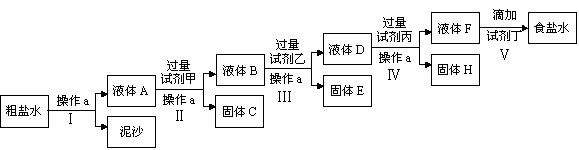
(14分)KCIO3在农业上用作除草剂,超细CaCO3广泛用于生产牙膏、无炭复写纸等。某同学在实验室模拟工业生产,利用制乙炔产生的残渣制备上述两种物质,过程如下:

I.残渣中主要成分是Ca(OH)2和 。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是 。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2 升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:
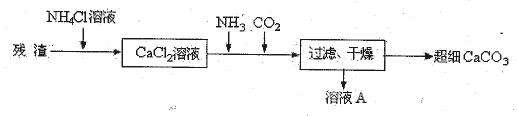
①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因 。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是 。
③图示的溶液A可循环使用,其主要成分的化学式是 。

I.残渣中主要成分是Ca(OH)2和 。
II.将I中的部分灰浆配成浊液,通入Cl2在一定的温度下只得到Ca(ClO3)2与CaCl2两种溶质,该反应的化学方程式是 。
Ⅲ、向II所得溶液中加入KCl,发生复分解反应,经蒸发浓缩,冷却结晶,过滤得49.0克KClO3晶体,则理论上至少需要标准状况下Cl2 升。
Ⅳ、将I中的残渣溶于NH4Cl溶液,加热,收集挥发出的气体再利用。向所得CaCl2溶液中依次通入NH3、CO2,便可获得超细CaCO3,过程如下:

①根据沉淀溶解平衡原理,解释残渣中难溶盐的溶解原因 。
②CaCl2溶液中通入两种气体后,生成超细CaCO3的化学方程式是 。
③图示的溶液A可循环使用,其主要成分的化学式是 。
(14分)
Ⅰ.CaCO3 (2分)
Ⅱ.6Cl2+6Ca(OH)2 = 5CaCl2+Ca(ClO3)2 + 6H2O (3分)
Ⅲ.26.88或26.9 (2分)
Ⅳ.① CaCO3(s) Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案) (2分)
Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案) (2分)
② CaCl2 + 2NH3 + CO2 + H2O ="=" CaCO3↓+ 2NH4Cl (3分)
③ NH4Cl (2分)
Ⅰ.CaCO3 (2分)
Ⅱ.6Cl2+6Ca(OH)2 = 5CaCl2+Ca(ClO3)2 + 6H2O (3分)
Ⅲ.26.88或26.9 (2分)
Ⅳ.① CaCO3(s)
 Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案) (2分)
Ca2++CO32-,NH4Cl溶液显酸性,使CO32-浓度减小,平衡向右移动,CaCO3溶解(或其他合理答案) (2分)② CaCl2 + 2NH3 + CO2 + H2O ="=" CaCO3↓+ 2NH4Cl (3分)
③ NH4Cl (2分)
电石与水反应生成乙炔和灰浆:氢氧化钙,氢氧化钙在风干的过程中与二氧化碳反应生成碳酸钙;由6Cl2~ Ca(ClO3)2~2 KClO3
6x22.4 2x122.5
V 49 V=" 6x22.4" x49/245=26.88L
Ⅳ: ① CaCO3存在沉淀溶解平衡CaCO3(s) Ca2++CO32-,而NH4Cl溶液水解产生的H+
Ca2++CO32-,而NH4Cl溶液水解产生的H+
与CO32-反应使CO32-浓度减小,平衡向右移动,CaCO3溶解;②生成超细CaCO3与侯氏制碱法原理相同,生成的NH4Cl可循环使用。
6x22.4 2x122.5
V 49 V=" 6x22.4" x49/245=26.88L
Ⅳ: ① CaCO3存在沉淀溶解平衡CaCO3(s)
 Ca2++CO32-,而NH4Cl溶液水解产生的H+
Ca2++CO32-,而NH4Cl溶液水解产生的H+与CO32-反应使CO32-浓度减小,平衡向右移动,CaCO3溶解;②生成超细CaCO3与侯氏制碱法原理相同,生成的NH4Cl可循环使用。

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 C2H4 ↑+ H2O
C2H4 ↑+ H2O
 请回答以下问题:
请回答以下问题:
 +8H2O
+8H2O