题目内容
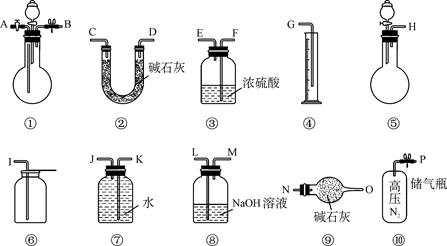
(15分)某过碳酸钠中含有少量过氧化钠,甲.乙两位同学各称取一定质量的该样品,并用如下图所示仪器测定样品的纯度。仪器的连接顺序,甲同学:⑤—⑧—③—⑦—④;乙同学:⑤—③—②。
已知:过碳酸钠(Na2CO4).过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4===2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为V L (20 ℃,1大气压),计算时他未将V L换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”')。
(2)乙同学想通过实验测得的数据是________________。按他测得的数据计算出的实验结果有可能偏高,原因是________________;也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。

已知:过碳酸钠(Na2CO4).过氧化钠分别跟足量稀硫酸反应的化学方程式如下:
2Na2CO4+2H2SO4===2Na2SO4+2CO2↑+O2↑+2H2O;
2Na2O2+2H2SO4===2Na2SO4+O2↑+2H2O。
(1)甲同学想通过实验测得的数据是____________,他选用的装置________(填序号)是没有必要的。实验中甲同学测得气体体积为V L (20 ℃,1大气压),计算时他未将V L换算到标准状况,则他得到的Na2CO4的质量分数________(填“偏高”或“偏低”')。
(2)乙同学想通过实验测得的数据是________________。按他测得的数据计算出的实验结果有可能偏高,原因是________________;也有可能偏低,原因是 。
(3)为了测得准确的实验数据,请你将乙同学的实验设计进行改进,写出你所选用仪器的连接顺序(每种仪器最多使用一次,也可以不用):________________(填序号)。
(1)生成的氧气的体积(2分) ③(2分) 偏低(2分)
(2)生成的二氧化碳的质量(2分) 空气中的水与二氧化碳进入②增重使结果偏大(2分) 产生的二氧化碳在装置⑤.③及导管中没有完全被②吸收使结果偏小(2分)
(3)⑩①③②⑨(3分)
(2)生成的二氧化碳的质量(2分) 空气中的水与二氧化碳进入②增重使结果偏大(2分) 产生的二氧化碳在装置⑤.③及导管中没有完全被②吸收使结果偏小(2分)
(3)⑩①③②⑨(3分)
(1)根据甲的实验原理可知,甲是想通过测量排出的水的体积来计算生成的氧气体积,进而来计算样品的纯度的,所以将氧气干燥是多余的。若未将未将V L换算到标准状况,则其体积偏大。而根据方程式可以看出,在质量相等时过氧化钠生成的氧气要多。所以Na2CO4的质量分数偏小。
(2)由乙的实验原理可知,乙是通过测量生成的二氧化碳的质量来测定其纯度的。由于空气中含有水饱和二氧化碳,所以有可能使装置②的质量增加,导致结果偏大。如果反应中生成的二氧化碳没有被②完全吸收,也有可能使测定的结果偏低。
(3)要使结果更准确,就必须使反应中生成的二氧化碳完全被碱石灰吸收,而且还需要保证空气中的水和二氧化碳不参与反应,所以正确的顺序是⑩①③②⑨。
(2)由乙的实验原理可知,乙是通过测量生成的二氧化碳的质量来测定其纯度的。由于空气中含有水饱和二氧化碳,所以有可能使装置②的质量增加,导致结果偏大。如果反应中生成的二氧化碳没有被②完全吸收,也有可能使测定的结果偏低。
(3)要使结果更准确,就必须使反应中生成的二氧化碳完全被碱石灰吸收,而且还需要保证空气中的水和二氧化碳不参与反应,所以正确的顺序是⑩①③②⑨。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
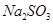 已被氧化(简述实验步骤):
已被氧化(简述实验步骤):