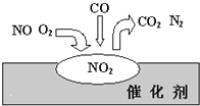
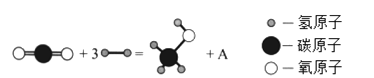
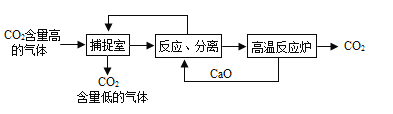
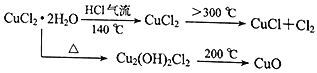��Ŀ����
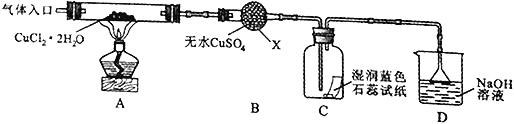
����Ŀ�����ӹ�ҵ�У�����FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣ijͬѧΪ�˴Ӹ�ʴ��Һ�л���ͭ�������»��FeCl3��Һ�������������ͼ
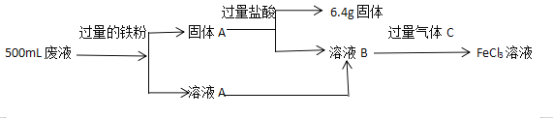
��ش��������⣺
��1��FeCl3��Һ��ʴͭ����Ӧ�����ӷ���ʽΪ___________��
��2������A�ijɷ���_______������C�Ļ�ѧʽΪ____________��
��3�����ʵ�鷽��֤��FeCl3��Һ�еĽ���������_____________��
��4����Ӧ��������11��2g�����Һ��Fe3�������ʵ���Ũ����____________��
���𰸡�2Fe3+ + Cu = 2Fe2+ + Cu2+ Fe Cu Cl2 ȡ������Һ���Թ��У��μӼ���KSCN��Һ�����ֺ�ɫ 0.4mol/L
��������
��������ͼ�������Ϣ����������Ӧ���������Һ����ɣ�������д��ط�Ӧ����ʽ���������Ũ�ȡ�
�ɹ������̿�֪����Һ��Ӧ�ú���FeCl3��FeCl2��CuCl2���ڷ�Һ�м�����������ۣ� FeCl3��Һ��Fe��Ӧ����FeCl2��Fe��CuCl2��Ӧ����Cu��������A��Fe��Cu�Ļ���Һ��A��FeCl2������A�м������ᣬFe�����ᷴӦ����FeCl2�����˵õ���6.4g�Ĺ��弴Ϊ����Cu����ҺB��FeCl2����ͨ������C�õ�FeCl3��������C������Cl2��
(1) FeCl3��Һ��ʴͭ����Ӧ�����ӷ���ʽΪ��2Fe3+ + Cu = 2Fe2+ + Cu2+��
�ʴ�Ϊ��2Fe3+ + Cu = 2Fe2+ + Cu2+��
(2)�����̷�����֪������A��Fe��Cu�Ļ������
�ʴ�Ϊ��Fe��Cu��
(3)����Fe3+������ʹ��KSCN��Һ������Ϊ��ȡ������Һ���Թ��У��μӼ���KSCN��Һ������Һ���ֺ�ɫ��˵����Һ�к���Fe3+��
�ʴ�Ϊ��ȡ������Һ���Թ��У��μӼ���KSCN��Һ�����ֺ�ɫ��
(4)��Ӧ���ĵ����۷ֱ�Ϊ��FeCl3��CuCl2�ķ�Ӧ������CuCl2+Fe=Cu+FeCl2��n(Fe)=n(Cu)=![]() =0.1mol�������Ȼ�����Ӧ���ĵ��������ʵ���Ϊ��n(Fe)=
=0.1mol�������Ȼ�����Ӧ���ĵ��������ʵ���Ϊ��n(Fe)=![]() =0.1mol������2Fe3+ +Fe= 3Fe2+�ã�n(Fe3+)=2 n(Fe)=2��0.1mol=0.2mol��c(Fe3��)=
=0.1mol������2Fe3+ +Fe= 3Fe2+�ã�n(Fe3+)=2 n(Fe)=2��0.1mol=0.2mol��c(Fe3��)=![]() =0.4mol/L��
=0.4mol/L��
�ʴ�Ϊ��0.4mol/L��

 �ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�
�ϴ�̸�������������νӽ̳��Ͼ���ѧ������ϵ�д�