题目内容
【题目】甲醇是一种重要的化工原料。利用CO2和 H2在催化剂的作用下合成甲醇,有关反应的反应热与平衡常数表示如下:
反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1 K1
CO(g)+H2O(g) △H1 K1
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2 K2
CH3OH(g) △H2 K2
总反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3 K3
CH3OH(g)+H2O(g) △H3 K3
(1)①△H3=_________(用△H1、△H2表示)。
②K3 =____________(用K1、K2表示)。
③在恒温恒容的密闭容器中,能判断总反应达平衡状态的依据是______(填番号)。
a.容器中的压强保持不变
b.H2的质量分数保持不变
c.有两个C=O键断裂的同时水分子中有两个H-O键断裂
d.化学平衡常数K保持不变
e.c(CO2) =c(H2O)
f.速率v (CO2) =v(H2O)
④在某温度下,反应体系达平衡时,增大体系的压强,体系中,反应1的平衡______移动(填“向正反应方向”、“向逆反应方向”和“不”)。
(2)以上平衡常数随温度变化的曲线如图所示:
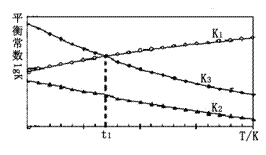
①则△H2_____△H3(填“大于”、“小于”或“等于”),理由是______________。
②温度为t1时,体系建立起化学平衡状态,测得c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)=________。
(3)甲醇可用于制取氰化氢。已知:Ka(HCN) = 6.0×10-10,Kw=1×10-14氰化钠水解的离子方程式为CN-+H2O![]() HCN+OH-。
HCN+OH-。
①该水解反的平衡常数的值Kh=_________。
②一种由等物质的量浓度的NaCN和HCN组成的缓冲溶液,该溶液的pH____7 (“>”、“<”或“=”)。
【答案】 △H1+△H2 K1·K2 a、b、c 向正反应方向 小于 由图可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律知:△H3=△H1+△H2,所以△H2<△H3 0.01 1.67×10-5 >
【解析】(1)①反应1:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H1,
CO(g)+H2O(g) △H1,
反应2:CO(g)+2H2(g) ![]() CH3OH(g) △H2,
CH3OH(g) △H2,
根据盖斯定律,将反应1+反应2得CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=△H1+△H2,故答案为:△H1+△H2;
CH3OH(g)+H2O(g) △H3=△H1+△H2,故答案为:△H1+△H2;
②反应相加,平衡常数相乘,因此K3 = K1K2,故答案为:K1·K2;
③a.该反应属于气体的物质的量发生变化的反应,在恒温恒容的密闭容器中,容器中的压强保持不变,说明气体的物质的量不再变化,说明处于化学平衡状态,正确;b.H2的质量分数保持不变,说明处于化学平衡状态,正确;c.有两个C=O键断裂的同时水分子中有两个H-O键断裂,说明正逆反应速率相等,说明处于化学平衡状态,正确;d.温度不变,化学平衡常数始终保持不变,不能说明处于化学平衡状态,错误;e.c(CO2) =c(H2O) ,不能说明处于化学平衡状态,错误;f.速率v (CO2) =v(H2O)未注明反应方向,无法判断是否为平衡状态,错误;故选abc;
④在某温度下,反应体系达平衡时,增大体系的压强,反应②和总反应均右移,因此反应1的平衡也右移,故答案为:向正反应方向;
(2)①由图可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律知:△H3=△H1+△H2,所以△H2<△H3,故答案为:小于;由图可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律知:△H3=△H1+△H2,所以△H2<△H3;
②温度为t1时,两者平衡常数相等,K1=![]() ,K3=
,K3=![]() ,因此
,因此![]() =
=![]() ,所以当c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)= c2(H2)=0.01,故答案为:0.01;
,所以当c(H2)=0.1 mol·L-1 ,c(CH3OH):c(CO)= c2(H2)=0.01,故答案为:0.01;
(3)①Kh= =
=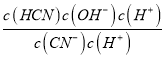 =
=![]() =
=![]() =1.67×10-5,故答案为:1.67×10-5;
=1.67×10-5,故答案为:1.67×10-5;
②根据Ka(HCN) = 6.0×10-10,Kh=1.67×10-5,可知由等物质的量浓度的NaCN和HCN组成的混合溶液中以水解为主,溶液显碱性,pH>7,故答案为:>。