题目内容
研究氮及其化合物具有重要意义.请回答下列问题:
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+N0(g)+N02(g)
2N2(g)+3H20(g)△H<0,反应的氧化剂是______.
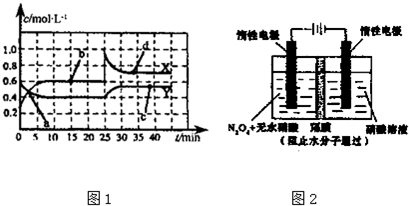
(2)已知NO2和N2O4可以相互转化:2N02(g)?N204(g)△H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图1所示.则图1中两条曲线X和Y,表示N2O4浓度变化的是______,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是______
(3)25℃时,将NH3溶于水得100mL0.1mol?L-1的氨水,测得pH=11,则该条件下,NH3?H2O的电离平衡常数Kb=______
(4)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ?mol-1
2NO(g)+O2(g)═2NO2(g)△H=-112kJ?mol-1
2C(s)+O2(g)═2CO△H=-221kJ?mol-1
C(s)+O2(g)═CO2△H=-393kJ?mol-1
则反应4CO(g)+2NO2═4CO2(g)+N2(g)△H=______.
(5)用电化学法可获得N205.如图2装置中,阳极的电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,则该电解反应的化学方程式为______.
(1)脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+N0(g)+N02(g)
| 催化剂 |
| 180℃ |
(2)已知NO2和N2O4可以相互转化:2N02(g)?N204(g)△H<0,现将一定量的混合气体通入一恒温密闭容器中反应,浓度随时间变化关系如图1所示.则图1中两条曲线X和Y,表示N2O4浓度变化的是______,b、c、d三点的化学反应速率大小关系是______;25min时,曲线发生图中变化,可采取的措施是______
(3)25℃时,将NH3溶于水得100mL0.1mol?L-1的氨水,测得pH=11,则该条件下,NH3?H2O的电离平衡常数Kb=______
(4)已知:N2(g)+O2(g)═2NO(g)△H=+180kJ?mol-1
2NO(g)+O2(g)═2NO2(g)△H=-112kJ?mol-1
2C(s)+O2(g)═2CO△H=-221kJ?mol-1
C(s)+O2(g)═CO2△H=-393kJ?mol-1
则反应4CO(g)+2NO2═4CO2(g)+N2(g)△H=______.
(5)用电化学法可获得N205.如图2装置中,阳极的电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,则该电解反应的化学方程式为______.

(1)根据氮元素的化合价的变化可知,N0、N02的化合价降低被还原,做氧化剂,故答案为:N0、N02;
(2)根据2N02(g)?N204(g)可知,N02的浓度变化应该是N204浓度变化的2倍,故变化慢的是N204;c、d两点是在同一时间段内的平衡状态上的两点,所以v(c)=v(d),又因为d点的二氧化氮的浓度比b点大,所以v(d)>v(b),因此v(c)=v(d)>v(b);25min时,根据曲线发生图中变化可知二氧化氮的浓度瞬间增大,而四氧化二氮没变,所以改变的条件是增加N02浓度;故答案为:Y;v(c)=v(d)>v(b);增加N02浓度;
(3)氨水溶液pH=11,则C(H+)═10-11 mol?L-1,C(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 0 0
反应(mol?L-1) 10-3 10-3 10-3
平衡(mol?L-1) 0.1 10-3 10-3
所以NH3?H2O的电离平衡常数为Kb=
=1.0×10-5mol?L-1;故答案为:1.0×10-5mol?L-1;
(4)已知N2(g)+O2(g)=2NO(g)△H1=+180kJ?mol-1,N2(g)+2O2(g)=2NO2(g)△H2=+68kJ?mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ?mol-1,C(s)+O2(g)=CO2(g)△H4=-393.5kJ?mol-1,根据盖斯定律,化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=4△H4-2△H3-△H2=-1200kJ?mol-1,故答案为:-1200kJ?mol-1;
(5)根据溶液呈酸性,阴极电极反应式为:2H++2e-═H2↑,阳极的电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,阴极和阳极电极反应式相加即可得到电解反应的化学方程式为N2O4+2HNO3
2N2O5+H2↑;故答案为:N2O4+2HNO3
2N2O5+H2↑.
(2)根据2N02(g)?N204(g)可知,N02的浓度变化应该是N204浓度变化的2倍,故变化慢的是N204;c、d两点是在同一时间段内的平衡状态上的两点,所以v(c)=v(d),又因为d点的二氧化氮的浓度比b点大,所以v(d)>v(b),因此v(c)=v(d)>v(b);25min时,根据曲线发生图中变化可知二氧化氮的浓度瞬间增大,而四氧化二氮没变,所以改变的条件是增加N02浓度;故答案为:Y;v(c)=v(d)>v(b);增加N02浓度;
(3)氨水溶液pH=11,则C(H+)═10-11 mol?L-1,C(0H-)═10-3mol?L-1,
NH3?H2O?NH4++OH-
起始(mol?L-1) 0.1 0 0
反应(mol?L-1) 10-3 10-3 10-3
平衡(mol?L-1) 0.1 10-3 10-3
所以NH3?H2O的电离平衡常数为Kb=
| 10-3×10-3 |
| 0.1 |
(4)已知N2(g)+O2(g)=2NO(g)△H1=+180kJ?mol-1,N2(g)+2O2(g)=2NO2(g)△H2=+68kJ?mol-1,2C(s)+O2(g)=2CO(g)△H3=-221kJ?mol-1,C(s)+O2(g)=CO2(g)△H4=-393.5kJ?mol-1,根据盖斯定律,化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=4△H4-2△H3-△H2=-1200kJ?mol-1,故答案为:-1200kJ?mol-1;
(5)根据溶液呈酸性,阴极电极反应式为:2H++2e-═H2↑,阳极的电极反应式为:N2O4+2HNO3-2e-═2N2O5+2H+,阴极和阳极电极反应式相加即可得到电解反应的化学方程式为N2O4+2HNO3
| ||
| ||

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目

 I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度  。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
