题目内容
下列反应的离子方程式书写正确的是( )
| A.向银氨溶液中加入盐酸:[Ag(NH3)2]++OH—+3H+=Ag++2NH4++H2O |
| B.NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3— +OH—+Ba2+=H2O+BaCO3↓ |
C.硫酸铝溶液显酸性:Al3++3H2O Al(OH) 3↓+3H+ Al(OH) 3↓+3H+ |
| D.在少量Mg(OH)2悬浊液中滴加氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3·H2O+Mg2+ |
D
解析试题分析:A、向银氨溶液中加入盐酸应有AgCl沉淀生成,错误;B、NaHCO3溶液和少量Ba(OH)2溶液混合,氢氧化钡不会有剩余,而离子方程式中仍有OH-剩余,错误;C、铝离子水解反应是可逆反应,生成的氢氧化铝不能画沉淀符号,错误;D、少量Mg(OH)2悬浊液中滴加氯化铵浓溶液,铵根离子与氢氧根离子结合生成一水合氨,使氢氧化镁的溶解平衡正向移动,氢氧化镁逐渐溶解,正确,答案选D。
考点:考查离子方程式的判断

练习册系列答案
相关题目
粒子甲与粒子乙在溶液中的转化关系如下图所示,粒子甲不可能是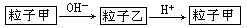
| A.NH4+ | B.Al | C.HCO3一 | D.SO2 |
下列反应的离子方程式正确的是( )
| A.NaHCO3溶液中加入盐酸:CO32-+ 2H+ = CO2↑+ H2O |
B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S 2H+ + S2- 2H+ + S2- |
| C.将NaHSO4溶液滴入Ba(OH)2溶液中至pH=7:2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O |
D.电解CuSO4溶液:Cu2+ + 2H2O Cu + O2↑+ 4H+ Cu + O2↑+ 4H+ |
室温下,某溶液中水电离出的H+浓度为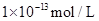 ,则该溶液中一定不可能大量存在的离子是
,则该溶液中一定不可能大量存在的离子是
| A.Cl— | B.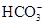 | C.Na+ | D.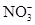 |
某同学向一支试管中按一定的顺序分别加入下列几种物质:
(a)KI溶液;(b)淀粉溶液;(c)NaOH溶液;(d)稀H2SO4溶液;(e)氯水。
溶液的颜色变化为:无色→ 棕黄色→ 蓝色→ 无色→ 蓝色。又知每种物质只加1次,由此可知加入试剂的先后顺序是( )
| A.( a ) →( e )→( b )→ ( c )→( d ) |
| B.( a )→( b ) →( e ) → ( c )→ ( d ) |
| C.( b )→( e )→ ( a )→ ( d )→( c ) |
| D.( a )→( d )→( b )→ ( e )→ ( c ) |
下列解释事实的反应方程式不正确的是
A.氨水使酚酞溶液变红: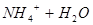 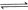 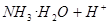 |
B.醋酸使碳酸钙溶解: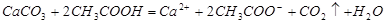 |
C.草酸溶液使高锰酸钾酸性溶液褪色: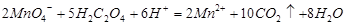 |
D.向污水中投放明矾,生成能凝聚悬浮物的胶体: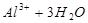 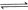 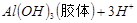 |
下列表示对应化学反应的离子方程式正确的是
A.MnO2与浓盐酸反应制Cl2:MnO2+4HCl Mn2++2Cl-+Cl2↑+2H2O Mn2++2Cl-+Cl2↑+2H2O |
| B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O ="==" Al(OH)3↓+3H+ |
| C.Na2O2溶于水产生O2:Na2O2+H2O ="==" 2Na++2OH-+O2↑ |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2++OH-="==" CaCO3↓+H2O |
下列说法正确的是
| A.液态HCl、固态NaCl均不导电,所以HCl、NaCl是非电解质 |
| B.NH3、CO2、Cl2的水溶液均能导电,所以NH3、CO2、Cl2均是电解质 |
| C.蔗糖、酒精在液态或水溶液里均不导电,所以它们是非电解质 |
| D.铜、石墨均导电,所以它们是电解质 |