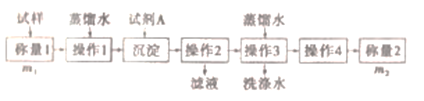
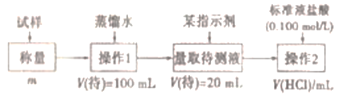
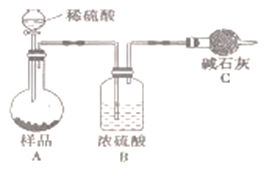
题目内容
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 1 mol Cl2与足量Fe反应,转移的电子数为3NA
B. 1 mol Cl2参加反应转移的电子数一定为2NA
C. 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA
D. 在反应KIO3+6HI![]() 3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
3I2+KI+3H2O中,每生成3 mol I2转移的电子数为5NA
【答案】D
【解析】
A项,1molCl2与足量的铁反应生成FeCl3,1molCl2全部反应,转移电子数为2NA,故A错误;B项,1 mol Cl2参加反应,可能被氧化、也可能被还原、还可能自身氧化还原,所以转移的电子数不一定为2NA,故B错误;C项,向FeI2溶液中通入Cl2,首先反应的是I-:FeI2+Cl2=FeCl2+I2,I-全部转化为I2后,Cl2再和Fe2+反应,当有1molFe2+被氧化时反应为:2FeI2+3Cl2=2FeCl3+2I2,则参加反应的Cl2的物质的量为1.5mol,即有1.5mol Cl2被还原,所以电子转移数目为3NA,故C错误;D项,KIO3中的I元素化合价从+5价到I2中的0价,得电子数为5,HI中的I元素化合价从-1价到I2中的0价,失电子数为1,根据电子得失守恒,反应6molHI中只有5molHI被氧化,所以每生成3 mol I2转移的电子数为5NA,故D正确。综上所述,符合题意的选项为D。

【题目】亚硝酸氯(ClNO)可由NO与Cl2在通常条件下反应得到,化学方程式为:2NO(g)+Cl2(g)![]() 2ClNO(g)。
2ClNO(g)。
(1)在一定温度下,该反应于一恒容密闭容器中达到平衡继续通入Cl2,逆反应速率____(填增大、减少、不变)。
(2)已知几种化学键的键能数据如下表(NO的结构为:N≡O;亚硝酸氯的结构为Cl-N=O)
化学键 | N≡O | Cl-Cl | Cl-N | N=O |
键能(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) △H=-111kJ/mol则a=______。
2ClNO(g) △H=-111kJ/mol则a=______。
(3)在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),在不同温度下测得c(ClNO)与时间的关系如图A:

①该反应的T1______T2(填“>”<”或“=”)。
②反应开始到10min时NO的平均反应速率v(NO)=_______mol/(L.min)。
③T2时该反应的平衡常数K=________。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图象如图B,则A、B、C三状态中,NO的转化率最大的是_____点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的____点。