题目内容
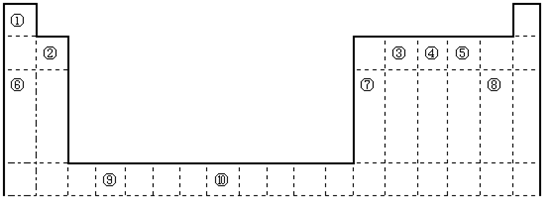
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若X原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,若X原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、元素X位于元素周期表的第二周期第ⅣA族 | B、元素W在自然界以化合态的形式存在 | C、Z的单质能在X的单质(X2)中燃烧生成ZX3 | D、元素Y的最高正化合价与元素W的相同 |
分析:X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X和Y属于第二周期元素、Z和W属于第三周期元素,若X原子的最外层电子数是内层电子数的3倍,X内层电子数是2,则X最外层电子数是6,则X是O元素、Y是F元素、Z是S元素、W是Cl元素,
A.根据X元素在周期表中的位置判断;
B.Cl元素是较活泼的非金属元素,在自然界中不能以游离态存在;
C.S单质在氧气中燃烧生成二氧化硫;
D.F元素没有最高正化合价.
A.根据X元素在周期表中的位置判断;
B.Cl元素是较活泼的非金属元素,在自然界中不能以游离态存在;
C.S单质在氧气中燃烧生成二氧化硫;
D.F元素没有最高正化合价.
解答:解:X、Y、Z、W均为短周期元素,根据元素在周期表中的位置知,X和Y属于第二周期元素、Z和W属于第三周期元素,若X原子的最外层电子数是内层电子数的3倍,X内层电子数是2,则X最外层电子数是6,则X是O元素、Y是F元素、Z是S元素、W是Cl元素,
A.X原子核外有2个电子层,最外层电子数是6,所以X位于元素周期表的第二周期第VIA族,故A错误;
B.Cl元素是较活泼的非金属元素,极易和其它物质反应,所以在自然界中不能以游离态存在,故B正确;
C.S单质在氧气中燃烧生成二氧化硫,二氧化硫在一定条件下反应生成三氧化硫,故C错误;
D.O、F元素没有最高正化合价,Cl元素最高正化合价为+7价,故D错误;
故选B.
A.X原子核外有2个电子层,最外层电子数是6,所以X位于元素周期表的第二周期第VIA族,故A错误;
B.Cl元素是较活泼的非金属元素,极易和其它物质反应,所以在自然界中不能以游离态存在,故B正确;
C.S单质在氧气中燃烧生成二氧化硫,二氧化硫在一定条件下反应生成三氧化硫,故C错误;
D.O、F元素没有最高正化合价,Cl元素最高正化合价为+7价,故D错误;
故选B.
点评:本题考查了元素周期表和元素周期律的综合应用,熟悉元素周期表结构及原子结构是解本题关键,结合元素、物质的性质来分析解答,注意:硫在氧气中燃烧都生成二氧化硫而不生成三氧化硫,与氧气量的多少无关,在主族元素中,元素的最高化合价与其族序数相等(O、F元素除外),为易错点.

练习册系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |