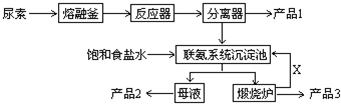
题目内容
12.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.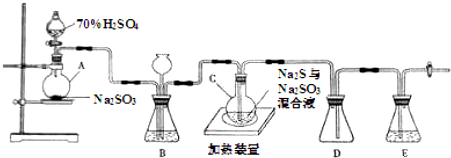
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则整个装置气密性良好.装置D的作用是防止倒吸,装置E中为NaOH溶液.
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c(填序号).
a.蒸馏水 b.饱和NaHSO3溶液
c.饱和Na2SO3溶液 d.饱和NaHCO3溶液
已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是控制滴加硫酸的速度.
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴入几滴BaCl2溶液,
若产生白色沉淀则说明产品中含有Na2SO4,若没有产生白色沉淀则说明产品中不含Na2SO4.
已知Na2S2O3•5H2O遇酸易分解:S2O32?+2H+=S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
分析 (1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3;
(3)观察SO2的生成速率,装置B中的溶液不能与二氧化硫反应也不能吸收二氧化硫,通过控制滴加硫酸的速度,可以控制产生二氧化硫的速率,据此答题;
(4)检测产品中是否存在Na2SO4,先加盐酸排除干扰,再利用氯化钡检验硫酸根离子.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:2:1;
(3)观察SO2的生成速率,发生强酸制取弱酸的反应,a不生成二氧化硫,bd中物质均与二氧化硫反应,只有c中饱和NaHSO3溶液适合制取二氧化硫,通过控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,
故答案为:c;控制滴加硫酸的速度;
(4)检测产品中是否存在Na2SO4,操作、现象和结论为取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴入几滴BaCl2溶液,若产生白色沉淀则说明产品中含有Na2SO4,若没有产生白色沉淀则说明产品中不含Na2SO4,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴入几滴BaCl2溶液,若产生白色沉淀则说明产品中含有Na2SO4,若没有产生白色沉淀则说明产品中不含Na2SO4.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,可以利用总反应的分析,题目难度中等.


有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
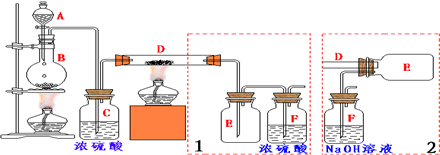
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下.
(3)请写出C装置中的离子反应方程式SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
(4)装置D中品红溶液的作用是验证二氧化硫是否被除尽.
(5)反应过程中应用冷水冷却装置E,其主要目的是减少液溴挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷易凝结成固体而发生堵塞.
(6)学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是乙醇挥发、副反应发生或反应太剧烈
(7)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,其原因是乙烯和液溴均易溶于四氯化碳.
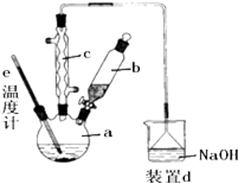 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如图:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/°C | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶[来 | 微溶 |
①装置c为球形冷凝管,冷凝水的水流方向为下进上出(填“上进下出”或“下进上出”).
②写出在a中发生的化学反应方程式2Fe+3Br2=2FeBr3、、C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr.
③装置d中NaOH溶液的作用是吸收HBr和Br2.
(2)液溴滴完后,经过下列步骤分离提纯:
Ⅰ向a中加入10mL水,然后过滤除去未反应的铁屑;
Ⅱ滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.
Ⅲ向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
回答下列问题:
①纯溴苯为无色油状液体,而a中得到的粗产品呈褐色,则粗产品中溶解的主要杂质是Br2(填化学式).
②用10%的NaOH溶液洗涤的目的是除去溴苯中溶解的杂质,该杂质为Br2(填化学式).
③加入氯化钙的目的是干燥.
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母).
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.