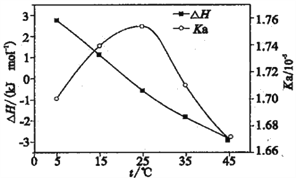
题目内容
【题目】设在容积可变的密闭容器中充入10 mol N2(g)和10 mol H2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。计算[(1)、(2)的计算都需按格式写计算过程,否则答案对也不给分]
(1)该条件下反应N2(g)+3H2(g)![]() 2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
2NH3(g) 的平衡常数________。(设该条件下,每1mol气体所占的体积为VL)
(2)上述反应的平衡时,再充入10 mol的N2,根据计算,平衡应向什么方向移动________
(3)某温度下将所得的氨气配成0.1 molL-1的溶液,所得溶液的pOH_____;将该溶液冲稀100倍;计算此时氨水的电离度为________(已知该温度下Kb(NH3·H2O) =1.0×10-5)
【答案】 8v2(mol·L-1)-2 平衡向逆反应方向移动 3 10%
【解析】试题分析:(1)首先,利用“三段式”计算平衡时N2、 H2、NH3的物质的量,再根据![]() 计算平衡常数;(2)先计算再充入10 mol的N2时的浓度熵Q,再根据Q、K的比较判断平衡移动方向;(3)根据Kb(NH3·H2O) =1.0×10-5,计算0.1 molL-1的溶液中c(OH-),再利用pOH=
计算平衡常数;(2)先计算再充入10 mol的N2时的浓度熵Q,再根据Q、K的比较判断平衡移动方向;(3)根据Kb(NH3·H2O) =1.0×10-5,计算0.1 molL-1的溶液中c(OH-),再利用pOH=![]() 计算;将该溶液冲稀100倍,则浓度变为10-3 molL-1,根据Kb(NH3·H2O) =1.0×10-5,计算c(NH4+);再根据c(NH4+)÷c(NH3·H2O)计算电离度;
计算;将该溶液冲稀100倍,则浓度变为10-3 molL-1,根据Kb(NH3·H2O) =1.0×10-5,计算c(NH4+);再根据c(NH4+)÷c(NH3·H2O)计算电离度;
解析:(1)设达到平衡时,消耗氮气的物质的量是xmol;

![]()
X=2mol
平衡时N2、 H2、NH3的物质的量分别是8mol、4mol、4mol,每1mol气体所占的体积为VL,所以容器的体积是16vL, 8v2(mol·L-1)-2。
8v2(mol·L-1)-2。
(2)上述反应的平衡时,再充入10 mol的N2,则N2、 H2、NH3的物质的量分别是18mol、4mol、4mol,每1mol气体所占的体积为VL,所以容器的体积是26vL,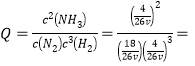 9.4v2(mol·L-1)-2>K,所以平衡向逆反应方向移动;(3) Kb(NH3·H2O)=
9.4v2(mol·L-1)-2>K,所以平衡向逆反应方向移动;(3) Kb(NH3·H2O)=![]() ,所以c(OH-)=10-3,pOH=
,所以c(OH-)=10-3,pOH=![]() =
=![]() =3;将该溶液冲稀100倍,则浓度变为10-3 molL-1,Kb(NH3·H2O)=
=3;将该溶液冲稀100倍,则浓度变为10-3 molL-1,Kb(NH3·H2O)=![]() ,c(NH4+)=10-4,电离度= c(NH4+)÷c(NH3·H2O)= 10-4÷10-3×100%=10%。
,c(NH4+)=10-4,电离度= c(NH4+)÷c(NH3·H2O)= 10-4÷10-3×100%=10%。

 字词句段篇系列答案
字词句段篇系列答案