题目内容
18.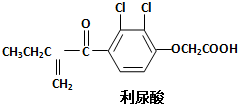 反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是( )
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如下:关于利尿酸的说法中,正确的是( )| A. | 它的分子式是C13H11O4Cl2 | |
| B. | 它不能使酸性高锰酸钾溶液褪色 | |
| C. | 它不能与饱和碳酸钠溶液反应放出CO2 | |
| D. | 它能发生取代反应、加成反应和酯化反应 |
分析 由结构可知,物质中含C、H、O、Cl四种元素,分子中含碳碳双键、碳氧双键、醚键、羧基及-Cl,结合不饱和键、氯代烃及羧酸的性质来解答.
解答 解:A.由结构简式可知分子式是C13H12O4Cl2,故A错误;
B.含碳碳双键,能使酸性高锰酸钾溶液褪色,故B错误;
C.含羧基(-COOH)能与饱和碳酸钠溶液反应放出CO2,故C错误;
D.含碳碳双键、碳氧双键及苯环可发生加成反应,含羧基可发生取代和酯化反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物中官能团与性质的关系为解答的关键,侧重烯烃及羧酸性质的考查,注意芳香烃与芳香族化合物的区别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.沙漠中的仙人掌和海洋中的鲸,组成它们的化学元素( )
| A. | 完全相同 | B. | 含量无差别 | C. | 大体相同 | D. | 毫无联系 |
6.下列各组有机物的同分异构体数目相等的是(不考虑立体异构)( )
| A. | C5H12和C4H8 | B. | C4H10和C3H8O | C. | C3H4和C4H9Cl | D. | C3H7Br和C2H6O |
13.下列有关化学与生活、工业的叙述中,不正确的是( )
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
10.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
如型l所示装置中,甲、乙、丙三个烧杯中依次盛放足量的A溶液、足量的B溶液、足量的c溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系如图2所示.请回答下列问题:
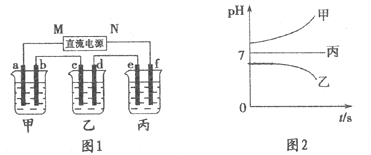
(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |

(1)M为直流电源的负极,b电极上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)计算e电极上生成的气体在标准状况下的体积为5.6L.
(3)写出乙烧杯中的总反应方程式:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?能,因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水.
(5)要使丙烧杯中的c溶液恢复到原来的状态,需要进行的操作是加入4.5gH2O.
7.下列有关元素性质递变情况的叙述中,正确的是( )
| A. | Li、Be、B原子最外层电子数依次减少 | |
| B. | P、S、Cl元素最高正价依次降低 | |
| C. | Na、K、Rb的金属性依次增强 | |
| D. | N、O、F原子半径依次增大 |
8.可逆反应H2(g)+I2(g)?2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
| A. | 混合气体的密度不再改变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变 | |
| D. | I2、H2在混合气体中的体积分数相等 |
 .Q的离子符号为OH-.
.Q的离子符号为OH-. +CH3Br$\stackrel{催化剂}{→}$
+CH3Br$\stackrel{催化剂}{→}$ +HBr
+HBr
 .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$
 +
+
 .
.