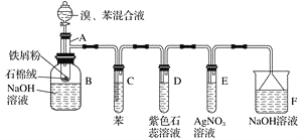
题目内容
【题目】在容积为2 L的密闭容器中,由CO2和H2合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

(1)下列说法正确的是_____________________(填序号);
①温度为T1时,从反应平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应为放热反应
③处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________________。
【答案】②③1-![]()
【解析】
(1)根据图像中的数据可知,温度T1时生成甲醇的速率=![]() mol·L-1·min-1,故①错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,故②正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故③正确。答案选②③;(2)写出方程式CO2+3H2
mol·L-1·min-1,故①错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,故②正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故③正确。答案选②③;(2)写出方程式CO2+3H2![]() CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为
CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为![]() =1-
=1-![]() 。
。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压)取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )
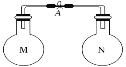
编号 | ① | ② | ③ | ④ |
气体M | HI | NH3 | H2 | NO |
气体N | Cl2 | HCl | N2 | O2 |
A. ①②③④ B. ③①④② C. ④①②③ D. ①④③②